XiaoMi-AI文件搜索系统
World File Search SystemUBR5 通过解除 RIG-I 类受体的转录制动器来促进抗病毒免疫
视黄酸诱导基因 I (RIG-I) 样受体 (RLR) 是启动抗病毒免疫反应所必需的主要病毒 RNA 传感器。RLR 受到严格的转录和翻译后调控,其中泛素化是最重要的调控之一。然而,泛素化在 RLR 转录中的作用尚不清楚。在这里,我们筛选了 375 种明确的泛素连接酶敲除细胞系,并确定泛素蛋白连接酶 E3 组分 N-识别素 5 (UBR5) 是 RLR 转录的正调节因子。UBR5 缺陷会降低对 RNA 病毒的抗病毒免疫反应,同时增加原代细胞和小鼠中的病毒复制。与野生型同窝仔相比,Ubr5 敲除小鼠更容易受到致命的 RNA 病毒感染。从机制上看,UBR5 介导三部分基序蛋白 28 (TRIM28) 的赖氨酸 63 连接泛素化,TRIM28 是 RLR 的表观遗传抑制因子。这种修饰可防止 TRIM28 的分子内 SUMO 化,从而解除 TRIM28 对 RLR 转录的抑制。总之,UBR5 通过泛素化和去 SUMO 化 TRIM28 实现 RLR 表达的快速上调,从而增强抗病毒免疫反应。
对糖皮质激素受体在前列腺癌中的作用的叙述性回顾:过去5年的发展
我们总结了GRS的同工型和涉及CRPC的机制。进行了更新的文献搜索,该搜索是关于CRPC中临床研究数据库中使用的类固醇激素(https://clinicaltrials.gov/),国家生物技术信息数据库中心(https://wwwwwww.ncbi.nlm.nih.gov/)和欧洲欧洲同盟的有效性(https://eudract.ema.europa.eu/)。重点是2017年至2022年的时间表。搜索的一般术语是NCBI数据库中的“糖皮质激素”和“前列腺癌”,“前列腺癌”和临床数据库中的“前列腺癌”和“糖皮质激素”。更具体的搜索标准:泼尼松/泼尼松/地塞米松和“前列腺癌”/“ CRPC”/“耐castration-耐药前列腺癌”。状态应完成或与结果进行试验。应包括至少一个原发性或次级结果[前列腺特异性抗原(PSA)反应率,无进展生存期(PFS)或总生存期(OS)(OS)和PSA进展的中位时间](请参见表1和表S1)。
激素受体和HER2作为乳腺癌的前瞻性分子标记的作用:更新
摘要本综述提供了有关当前方法,原理和作用机理,用于检测乳腺癌进展和复发预后的治疗性能分子标志物,包括雌激素受体(ER),孕激素受体(PR)和人类胚芽生长因子受体2(HERS 2)。的确,激素受体,即ER,PR,原癌基因HER2是基本的分子标记物,用于治疗实践,被识别和确定的预后因素和反应的预测指标。可以通过使用免疫疗法化学(IHC)和原位杂交(FISH)来检测这些标记,这些(FISH)是建立,更快且具有成本效益的检测方法的。这些分子标志物以及临床病理预后参数可以最好地预测癌症复发和进展的预后。最后,作为分子标记物的激素受体和HER2具有主要的治疗意义,并且有能力参与未来的药物开发技术。版权所有ª2020年,重庆医科大学。Elsevier B.V.这是CC BY-NC-ND许可证(http://creativecommons.org/licenses/by-nc-nd/4.0/)下的开放访问文章。
针对缓激肽 B1 和 B2 受体的分子成像剂的系统评价
摘要:激肽、缓激肽和激肽是通过缓激肽 B1 和 B2 受体(B1R 和 B2R)发出信号的血管活性肽。B2R 在健康组织中组成性表达,并介导血管舒张、液体平衡和滞留、平滑肌收缩和痛觉等反应,而 B1R 在正常组织中不存在,由组织创伤或炎症引起。B2R 由激肽激活,而 B1R 由缺乏 C 端精氨酸残基的激肽激活。激肽系统的紊乱与炎症、慢性疼痛、血管病变、神经病变、肥胖、糖尿病和癌症有关。一般来说,激肽系统的过度激活和信号传导会导致促炎状态。根据疾病背景,缓激肽受体的激动或拮抗已被视为治疗选择。在本综述中,我们总结了针对这些 G 蛋白偶联受体的分子成像剂,包括光学和放射性探针,它们分别用于在细胞和解剖水平上检测 B1R/B2R 表达。本文描述的几种临床前药物有可能指导这些受体的治疗干预。
在快速生长素反应中TIR1/AFB生长素受体的鸟苷酸环化酶活性
类似的小分子CGMP是GC活性的产物,是动物中的另一个关键第二信使(16)。通过审查的序列分析,我们发现了一个相对保守的GC基序(17),与先前表征的AC基序(15)相邻,在TIR1/AFB的C末端区域(图1a)。为了测试TIR1/AFB生长素受体的潜在GC活性,我们使用了从SF9昆虫细胞中纯化的HIS-GFP-FLAG-TIR1,GST-AFB1以及GST-AFB5蛋白纯化了30
GP60 和 SPARC 作为白蛋白受体:抗肿瘤药物输送的关键靶位
白蛋白来源于人或动物血液,能与大量内源性或外源性生物分子结合,是一种理想的药物载体,因此以白蛋白为基础的药物递送系统的研究日益增多,详细研究白蛋白类药物载体的转运机制显得尤为重要。作为白蛋白受体,糖蛋白60(GP60)和富含半胱氨酸的酸性分泌蛋白(SPARC)在白蛋白类药物载体的递送中起着至关重要的作用。GP60在血管内皮细胞上表达,使白蛋白能够穿过血管内皮细胞层,SPARC在多种肿瘤细胞中过表达,而在正常组织细胞中表达极少。因此,本综述对现有文章进行了补充,详细介绍了GP60或SPARC的研究历史和具体生物学功能以及利用白蛋白作为载体递送抗肿瘤药物的研究进展。同时也指出了白蛋白与GP60和SPARC相互作用研究中存在的不足和未来的发展方向。
酒精引起的行为和免疫扰动通过CB2大麻素受体的激活减弱
内源性大麻素(Ecbome)是扩展的内源性大麻素系统(ECS),研究表明,该系统与该系统如何调节酒精诱导的神经蛋白流量之间存在联系。使用有条件的敲除(CKO)小鼠在多巴胺神经元(DAT-CNR2)中选择性缺失2型2型受体(CB2RS)和小胶质细胞(CX3CR1-CNR2)中,我们研究了CB2RS如何调节行为和神经蛋白毒素诱导的cb2RS。的行为测试,包括运动和车轮跑活动,旋转rod性能测试以及酒精偏好测试,用于评估酒精诱导的行为变化。使用ELISA分析,我们研究了促炎细胞因子,肿瘤坏死因子-α(TNF-α),白介素-6(IL-6),白介素-1α(IL-1α)(IL-1α)和脑粒属1β(IL-1β(IL-1β)的水平。发现表明运动活性,车轮运行和旋转性性能活动受到多巴胺神经元和小胶质细胞中CB2RS的细胞类型缺失的显着影响。非选择性CB2R激动剂Win 55,212-2,野生型和细胞类型的CB2R CKO小鼠的酒精偏好降低。此外,结果表明,CB2RS本身的细胞类型的特异性缺失,并将酒精施用至CB2R CKO小鼠增加了海马中促炎性细胞因子的表达。这些发现表明CB2RS参与了调节酒精引起的行为和免疫改变。
“开放芝麻”对癌症中髓样衍生抑制细胞的模式识别受体的复杂性
模式识别受体是原始的传感器,它引起了对广泛刺激的预防剂的免疫反应,包括非病原体相关和自体损伤相关的分子模式分子。这些受体主要由先天髓样细胞表达,包括粒细胞,单核细胞,巨噬细胞和树突状细胞。最近的调查揭示了对这些受体的新见解,这不仅是在针对病原体侵袭的弹药过程中触发的主要参与者,而且还介导了包括癌症在内的特定病理状态中的免疫抑制。髓样衍生的抑制细胞在许多病理条件下优先扩展。这种异质细胞种群包括免疫抑制髓样细胞,被认为与预后不良和对各种癌症免疫治疗的反应受损有关。鉴定模式识别受体及其配体增加了对免疫激活和免疫抑制性髓样细胞功能的理解,并在健康条件下对髓样衍生的抑制细胞的差异阐明了髓样衍生的抑制细胞差异。本综述总结了不同表达,配体识别,信号传导途径以及癌症关系以及鉴定类似于Toll样的受体作为癌症中类髓样衍生的抑制细胞的潜在新靶标,这可能有助于我们解密指导代码,以将抑制性髓样细胞转移到抗肿瘤现象上。
精神分裂症中功能活性5-HT1A受体的体内成像:概念和挑战
摘要5-羟色胺5-HT 1A受体引起了广泛的关注,作为治疗精神疾病的靶标。尽管该受体在新一代抗精神病药的作用的药理机制中很重要,但其表征仍然不完整。基于自显影术对脑组织的体外分子成像的研究,以及最近的体内PET成像,尚未产生明确的结果,特别是由于当前5-HT 1A放射性培训的局限性,由于缺乏特定的特异性和/或与所有5-HT 1A受体结合,无论其功能能力。功能活性G蛋白偶联受体的PET神经影像学的新概念使得通过启用新的研究范式来重新访问PET脑探索。对于5-HT 1A受体,现在可以使用具有高效能性激动剂特性的5-HT 1A受体放射性物体[18 f] -f13640,以特定可视化和量化功能活性受体,并将这些信息与受试者的病理学或药理学或药理学或药理学状态相关联。因此,我们提出成像协议,以遵循与情绪降低或认知过程有关的功能性5-HT 1A受体模式的变化。这可以改善对不同精神分裂症表型的歧视,并对对抗精神病药的治疗反应基础有更深入的了解。最后,除了靶向功能活跃的受体以洞悉5-HT 1A受体的作用外,该概念也可以扩展到对参与精神疾病的病理生理学或治疗的其他受体的研究。
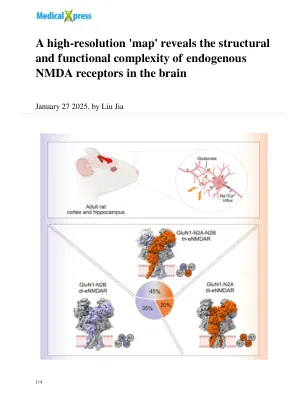
高分辨率“地图”揭示了大脑内源性 NMDA 受体的结构和功能复杂性
在《细胞》杂志发表的一项研究中,中国科学院脑科学与智能技术卓越创新中心朱树嘉团队与中国科学院上海药物研究所李阳团队解析了成年哺乳动物大脑皮层和海马体中内源性N-甲基-ᴅ-天冬氨酸受体(eNMDAR)的组装和结构。