XiaoMi-AI文件搜索系统
World File Search System肺炎球菌 21 价结合疫苗 (CAPVAXIVE) 专著 2024 年 11 月
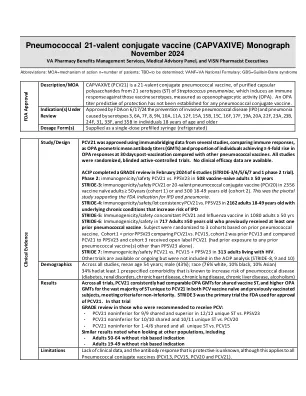
研究/设计 PCV21 获得批准,使用了多项研究的免疫桥接数据,比较了免疫反应,如 OPA 几何平均抗体滴度 (GMT) 和接种后 30 天内与其他肺炎球菌疫苗相比 OPA 反应增加 ≥ 4 倍的个体比例。所有研究均为随机、盲法活性对照试验。没有可用的临床疗效数据。ACIP 于 2024 年 2 月完成了对 6 项研究(STRIDE-3/4/5/6/7 和 1 项 2 期试验)的 GRADE 审查。第 2 阶段:在 508 名 ≥ 50 岁未接种疫苗的成年人中,PCV21 与 PPSV23 的免疫原性/安全性 STRIDE-3:在 2356 名 ≥ 50 岁未接种疫苗的成年人(队列 1)或 300 名 18-49 岁(队列 2)中,PCV21 或 20 价肺炎球菌结合疫苗 (PCV20) 的免疫原性/安全性。这是支持 FDA 针对 IPD 和肺炎的适应症的关键研究。 STRIDE-4:在 2162 名 18-49 岁患有潜在慢性疾病(会增加 IPD 风险)的成人中,PCV21 与 PPSV23 的免疫原性/安全性/批次一致性 STRIDE-5:在 1080 名 ≥ 50 岁的成人中,PCV21 和流感疫苗同时接种的免疫原性/安全性 STRIDE-6:在 717 名 ≥ 50 岁且曾接种过至少一次肺炎球菌疫苗的成人中,进行免疫原性/安全性测试。根据之前的肺炎球菌疫苗接种情况,受试者被随机分为 3 个组。组 1 = 之前的 PPSV23,比较 PCV21 与 PCV15,组 2 是之前的 PCV13,并将 PCV21 与 PPSV23 进行比较,组 3 接受了开放标签 PCV21(之前曾接触过除 PPSV23 以外的任何肺炎球菌疫苗)。 STRIDE 7:313 名 HIV 感染成人中 PCV21 与 PCV15 + PPSV23 的免疫原性/安全性。其他试验可用或正在进行,但未包含在 ACIP 分析中(STRIDE-8、9 和 10)人口统计所有研究中,平均年龄 54 岁;男性(43%);种族(76% 白种人、10% 黑人、10% 亚洲人)34% 患有至少一种已知会增加肺炎球菌疾病风险的预先指定的合并症(糖尿病、肾脏疾病、慢性心脏病、慢性肺病、慢性肝病、酗酒)结果在所有试验中,PCV21 在共享疫苗 ST 中始终具有可比的 OPA GMT,并且对于 PCV21 独有的绝大多数 ST 具有更高的 OPA GMT,无论是 PCV 疫苗初次接种还是之前接种过疫苗的受试者,都符合非劣效性标准。 STRIDE 3 是 FDA 用于批准 PCV21 的主要试验。在该试验中,GRADE 对建议接受 PCV 治疗的患者进行了评估:
使用 Jynneos/Imvanex (MVA-BN) 疫苗治疗猴痘的剂量注意事项
2022 年 8 月 19 日 EMA/700120/2022 紧急工作组 关于使用 Jynneos/Imvanex (MVA-BN) 疫苗预防猴痘的剂量学考虑 简介 2022 年 7 月 23 日,世界卫生组织 (WHO) 宣布猴痘疫情为国际关注的突发公共卫生事件 (PHEIC)。该疾病是由猴痘病毒引起的,猴痘病毒是一种与天花病毒密切相关的正痘病毒。Imvanex (Bavarian Nordic A/S) 是欧盟唯一获准用于预防成人天花、猴痘 1 和痘苗病毒引起的疾病的疫苗。Imvanex 是一种基于改良安卡拉痘苗-巴伐利亚北欧载体 (MVA-BN) 的非复制型减毒活第三代疫苗。它通过皮下注射给药,两剂间隔至少 28 天。疫苗在欧盟获得批准是在特殊情况下。由于天花病毒不再传播,因此无法生成功效数据,而且由于当前紧急情况发生之前人类疾病的流行病学,估计疫苗对猴痘的功效被认为是不可行的。在美国(Jynneos)和加拿大(Imvamune)以及其他相关的正痘病毒(仅限加拿大)中,同一种疫苗被批准用于成人,以预防天花和猴痘病毒引起的感染和疾病。不同地区的各种营销授权在制造工艺和质量规格方面存在细微差异,这是由于数据集的差异造成的,但不会影响疫苗的最终质量。由于欧盟批准的疫苗 Imvanex 无法立即获得,为了迅速控制疫情,欧洲卫生应急准备和应对局 (HERA) 购买了美国制造的疫苗 Jynneos 以捐赠给欧盟成员国。 EMA 紧急工作组 (ETF) 与 CHMP 生物制品工作组 (BWP) 和欧洲药品质量管理局 (EDQM) 联合评估了 FDA 批准的 Jynneos 的特性,并准备了一份公开声明 2,其中包括安全性、有效性和制造注意事项,以防 Jynneos 在欧盟用作 Imvanex 的替代品。然而,鉴于全球对这种疫苗的需求突然增加,疫苗供应目前有限。为了在病例不断增加的情况下尽量减少目前的短缺,ETF 评估了现有的证据,支持抗原保留 (部分剂量皮内给药) 的疫苗接种策略,该策略基于批准的液体制剂 (注射用混悬液) 用于皮下给药,其中每 0.5 mL 剂量含有不少于 5 x 10 7 个感染单位的改良安卡拉痘苗 - 巴伐利亚北欧活病毒,装在单剂量 I 型玻璃小瓶中。现有证据总结 皮内注射疫苗可减少抗原,已获批准用于多种疫苗,尤其是 BCG(结核疫苗)、流感和狂犬病疫苗。一项 II 期临床试验 (NCT 00914732) 3 研究了皮内注射减量 MVA-BN 的方法。未接种过天花疫苗的健康成人(18-38 岁)随机分配接受 2 次皮下 [SC] 剂量(0.5 mL,10 8 TCID50/剂)在三角肌区域或 2 次皮内 [ID] 剂量(0.1 mL,2x10 7 TCID50/剂)在前臂掌侧区域,间隔 4 周。试验中接种的疫苗可被视为与目前上市的产品相似,即使标称强度的描述不同。 IMVANEX 的较低皮下剂量(皮下剂量的五分之一)在免疫学上不劣于标准皮下剂量。第二次接种后(第 42-208 天),对 MVA 的峰值几何平均中和滴度 (GMT)
FDA-辉瑞
2022 年 5 月 27 日,辉瑞向 FDA 提交了一份请求,要求修改辉瑞-BioNTech COVID-19 疫苗 (BNT162b2) 的紧急使用授权 (EUA),用于预防由严重急性呼吸综合征冠状病毒 2 (SARS-CoV-2) 引起的 2019 冠状病毒病 (COVID-19)。该修正案将扩大 BNT162b2 的用途,包括 3 剂初级系列 (每剂 3 µg),用于 6 个月至 4 岁的婴儿和儿童。辉瑞在其请求中提交了正在进行的随机、双盲、安慰剂对照试验 C4591007 的安全性、免疫原性和初步描述性功效数据。6 个月至 4 岁的受试者按 2:1 的比例随机分配接受 2 剂 BNT162b2(每剂 3 µg mRNA)或盐水安慰剂,间隔 3 周给药。在分析了第 2 剂后的安全性和有效性数据后,对方案进行了修改,在第 2 剂后至少 8 周对 6 个月至 4 岁的参与者施用第三个主要系列剂量。 EUA 请求包括 1,178 名 BNT162b2 接受者和 598 名 6 个月至 23 个月(以下简称 6-23 个月)年龄的安慰剂接受者的 2/3 期安全性数据;以及 1,835 名 BNT162b2 接受者和 915 名 2 岁至 4 岁(以下简称 2-4 岁)年龄的安慰剂接受者,他们至少接受了一剂研究产品。在 2022 年 4 月 29 日数据截止时,在 6 个月至 4 岁的参与者中,中位随访时间为第 3 剂后 2.1 个月(包括盲法和开放标签随访)。在研究 C4591007 中,疫苗有效性是根据 SARS-CoV-2 50% 中和抗体滴度 (NT50,SARS-CoV-2 mNG 微量中和试验) 通过免疫桥接推断的。在进一步划分的两个年龄组 (6-23 个月和 2-4 岁) 中,将第 3 剂后 1 个月的中和抗体滴度与第 2 剂后 1 个月的滴度进行比较,这些中和抗体滴度来自在 2/3 期功效研究 C4591001 中已接受两剂 30 μg BNT162b2 的 16-25 岁随机选择的参与者子集。还提供了对接受 3 次研究疫苗接种的参与者的疫苗有效性 (VE) 的初步描述性分析 (在第 3 剂后至少 7 天内累计出现 10 例确诊的 COVID-19 病例)。主要免疫原性终点是评估在第 3 剂后 1 个月内无 SARS-CoV-2 感染证据的参与者中,通过微量中和试验评估针对 USA_WA1/2020 参考毒株(武汉样毒株)的中和抗体滴度。按照以下顺序对 6-23 个月和 2-4 岁年龄组中的每个年龄组依次测试免疫桥接终点和统计成功标准:•在研究 C4591007 中测量的第 2/3 期 6-23 个月参与者的第 3 剂后 1 个月的 SARS-CoV-2 中和抗体几何平均滴度(GMT),与在研究 C4591001 中随机选择的 16-25 岁参与者子集中测量的第 2 剂后 1 个月的 GMT,免疫桥接成功标准为 GMT 比率(儿童年龄组/16-25 岁)95% 置信区间 (CI) 下限 >0.67,GMT 比率的点估计值≥1.0。• 血清反应率(SARS-CoV-2 中和抗体滴度较第 1 剂前基线上升≥4 倍的参与者百分比),免疫桥接成功标准为血清反应率差异(儿童年龄组减去 16-25 岁)95% CI 下限 >−10%。如上所述,两个年龄组均符合免疫桥接统计成功标准。与基线时有 SARS-CoV-2 感染证据的两个年龄组参与者相比,第 3 剂后中和抗体 GMT 在数值上更高
217900orig1s000 -AccessData.fda.gov
表82。 Simulated and Observed Geometric Mean PK Parameters for Deuruxolitinib After a Single 16-mg Oral Dose in Healthy Subjects .............................................................................. 263 Table 83. 在健康受试者中单个20毫克口服剂量后,模拟和观察到的几何均值PK参数..................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... 在健康受试者中,第一次和多次口服剂量的8-mg脱发和多次口服剂量的8-mg脱发和多剂量的算术平均PK参数在健康受试者中出现7天。265表85。 在健康受试者中,第一次和多次口服剂量的16毫克脱发和多次口服剂量的16毫克脱发和多次口服剂量在健康受试者中出价7天.............................................................................................................在不存在和存在efavirenz的情况下,去毒素........................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... 269表87。 Simulated Geometric Mean AUC 0-t and C max Values and Corresponding GMRs for Deuruxolitinib in the Absence and Presence of Sulphaphenazole (500 mg BID) ....................... 269 Table 88. Simulated Geometric Mean AUC 0-t and C max Values and Corresponding GMRs for Deuruxolitinib in the Absence and Presence of Sulphaphenazole (2000 mg QD) ..................... 270 Table 89. Model Simulation PK Parameters for Tolbutamide and Warfarin Alone and in the Presence of Sulphaphenazole 2000 mg QD ............................................................................... 271 Table 90.表82。Simulated and Observed Geometric Mean PK Parameters for Deuruxolitinib After a Single 16-mg Oral Dose in Healthy Subjects .............................................................................. 263 Table 83.在健康受试者中单个20毫克口服剂量后,模拟和观察到的几何均值PK参数.....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................在健康受试者中,第一次和多次口服剂量的8-mg脱发和多次口服剂量的8-mg脱发和多剂量的算术平均PK参数在健康受试者中出现7天。265表85。在健康受试者中,第一次和多次口服剂量的16毫克脱发和多次口服剂量的16毫克脱发和多次口服剂量在健康受试者中出价7天.............................................................................................................在不存在和存在efavirenz的情况下,去毒素........................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... 269表87。Simulated Geometric Mean AUC 0-t and C max Values and Corresponding GMRs for Deuruxolitinib in the Absence and Presence of Sulphaphenazole (500 mg BID) ....................... 269 Table 88.Simulated Geometric Mean AUC 0-t and C max Values and Corresponding GMRs for Deuruxolitinib in the Absence and Presence of Sulphaphenazole (2000 mg QD) ..................... 270 Table 89.Model Simulation PK Parameters for Tolbutamide and Warfarin Alone and in the Presence of Sulphaphenazole 2000 mg QD ............................................................................... 271 Table 90.Input Parameters (ADME) for SV-Sulphaphenazole ................................................... 271 Table 91.在正常代谢器和CYP2C9*3*3*3*3基因分型受试者中单个12毫克口服剂量后,脱发的几何平均PK参数。在不存在和存在itraconazole(200 mg qd)的情况下,在正常代谢剂中,去毒素的几何均值AUC 0-T和C最大值在CYP2C9*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3* 单独的正常代谢剂中的去尿素甲替尼的模拟几何均值AUC 0-T和C最大值,在CYP2C9*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*的情况下, 。 Validation Summary for the Determination of Deuruxolitinib, C-21714 and C-21717 Plasma Concentrations ............................................................................................................. 274 Table 95. 的平均值和平均变化与HADS总分的基线相比,基线和第24周观察到的HADS得分..................................................................................................................................................................................................................................................................................................................................................... 275在正常代谢剂中,去毒素的几何均值AUC 0-T和C最大值在CYP2C9*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*单独的正常代谢剂中的去尿素甲替尼的模拟几何均值AUC 0-T和C最大值,在CYP2C9*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*3*的情况下, 。 Validation Summary for the Determination of Deuruxolitinib, C-21714 and C-21717 Plasma Concentrations ............................................................................................................. 274 Table 95. 的平均值和平均变化与HADS总分的基线相比,基线和第24周观察到的HADS得分..................................................................................................................................................................................................................................................................................................................................................... 275。 Validation Summary for the Determination of Deuruxolitinib, C-21714 and C-21717 Plasma Concentrations ............................................................................................................. 274 Table 95. 的平均值和平均变化与HADS总分的基线相比,基线和第24周观察到的HADS得分..................................................................................................................................................................................................................................................................................................................................................... 275。Validation Summary for the Determination of Deuruxolitinib, C-21714 and C-21717 Plasma Concentrations ............................................................................................................. 274 Table 95.的平均值和平均变化与HADS总分的基线相比,基线和第24周观察到的HADS得分..................................................................................................................................................................................................................................................................................................................................................... 275