XiaoMi-AI文件搜索系统
World File Search System共价蛋白作为靶向放射性核素疗法增强抗肿瘤作用
摘要:分子靶向放射性核素疗法 (TRT) 难以平衡疗效和安全性,因为目前增加肿瘤吸收的策略通常会改变药物药代动力学以延长血液循环和正常组织照射时间。我们在此报告了第一个共价蛋白 TRT,它通过与靶标发生不可逆反应,增加了肿瘤的放射性剂量,而不会改变药物的药代动力学特征或正常组织的生物分布。通过遗传密码扩展,我们将潜在的生物反应性氨基酸设计成纳米抗体,该抗体与其靶蛋白结合并通过邻近反应形成共价键,在体外、癌细胞和体内肿瘤上不可逆地交联靶标。放射性标记的共价纳米抗体显着增加了肿瘤中的放射性同位素水平并延长了肿瘤的停留时间,同时保持了快速的全身清除。此外,与 α 发射体锕-225 结合的共价纳米抗体比非共价纳米抗体更有效地抑制肿瘤生长,而不会引起组织毒性。这种化学策略将基于蛋白质的 TRT 从非共价模式转变为共价模式,改善了肿瘤对 TRT 的反应,并且可以很容易地扩展到针对广泛肿瘤靶点的多种蛋白质放射性药物。■ 简介
T细胞中的基因工程糖酵解增加了其抗肿瘤功能
通讯作者:Ang Li,Baylor医学院,One Baylor Plaza,011DF,休斯敦,德克萨斯州77030,电话:713-798-3667;传真:713-798-3750,ang.li2@bcm.edu。*具有同等贡献的同等贡献作者的联合第一作者具有同等贡献作者身份的贡献:ZZ执行了统计分析,解释了数据并编写了手稿。WH进行了生物信息学分析,解释了数据并严格修订了手稿。QW进行了统计分析。st和JL进行了生物信息学分析。PB和RSM创建了遗传途径,并严格修订了手稿。CIA,CC,SS,VAK,JD和PJM解释了数据,并严格修订了手稿。 PKB设计了研究并严格修订了手稿。 al设计了研究,进行了统计分析,解释了数据并撰写了手稿。CIA,CC,SS,VAK,JD和PJM解释了数据,并严格修订了手稿。PKB设计了研究并严格修订了手稿。al设计了研究,进行了统计分析,解释了数据并撰写了手稿。
有希望的抗肿瘤活性和联合疗法中ivonescimab的安全性
Miami, Florida, September 16, 2024 – Summit Therapeutics Inc. (NASDAQ: SMMT) (“Summit,” “we,” or the “Company”) today announced that data for the novel, potential first-in-class investigational bispecific antibody, ivonescimab, was presented at the 2024 European Society for Medical Oncology Annual Meeting (ESMO 2024) in Barcelona, Spain, including两次演讲和一张海报,包括晚期三阴性乳腺癌(TNBC),复发 /转移性头部和颈部鳞状细胞癌(HNSCC)和转移性微片剂稳定(MSS)结直肠癌(CRC)的两次介绍。生成数据的每个试验都是由Akeso Inc.(HKEX代码:9926.HK)赞助的II期研究,并由Akeso生成和分析。基于这些II期数据集的结果以及2024年前早些时候宣布的数据,包括早期非小细胞肺癌和胆道癌症,萨米特打算探索在转移性非小细胞肺癌中,在转移性非小细胞肺癌中,在其阶段III临床试验中,在转移性非小细胞肺癌中的实体瘤环境中的IVONESCIMAB的进一步临床开发。转移性MSS大肠癌第一次口腔介绍是由Sun Yat-Sen University的Yanhong Deng博士提出的。介绍的标题为“有或没有Ligufalimab的ivonescimab的功效和安全性,与FOLFOXIRI(化学疗法)作为转移性CRC的一线治疗,介绍了AK112-206的当前数据,包括来自该单一区域,多中心,II阶段的患者的AK112-206的数据,包括来自AK112-206的数据。 (NCT05382442)。该研究旨在评估被随机分配接受ivonescimab和folfoxiri的患者,其中有或没有Ligufalimab(抗CD47单克隆抗体)。请注意,Ligufalimab或AK117是Akeso专有的研究产品,未经任何监管机构批准,并且Summit没有任何许可证或所有权。截至2024年2月29日,22名患者接受了Ivonescimab加上Folfoxiri(“ A组”,中位随访时间为9个月); 18例患者接受了ivonescimab加上Ligufalimab加上Folfoxiri(“ B组”,中位随访时间为9.6个月)。
开发一流的RIPK1降解器以增强抗肿瘤免疫力
(未通过同行评审认证)是作者/资助者。保留所有权利。未经许可就不允许重复使用。此预印本版的版权持有人于2024年3月29日发布。 https://doi.org/10.1101/2024.03.25.586133 doi:Biorxiv Preprint
CDK9 PROTAC 化合物对 HER2 阳性乳腺癌的抗肿瘤活性
1 阿尔巴塞特大学医院转化研究部,02008 阿尔巴塞特,西班牙; mariadelmar.noblejas@uclm.es(MdMN-L.); evamaria.galan@uclm.es(EMG-M.); raquel.lrosa@uclm.es (RL-R.); david.tebar@uclm.es(DT-G.); mgomezj@sescam.jccm.es(MG-J.); mburgosloz@unav.es (MB) 2 地区生物医学研究中心 (CRIB),卡斯蒂利亚-拉曼恰大学 (UCLM),02008 阿尔瓦塞特,西班牙 3 癌症分子和皮肤生物学研究所,CSIC、IBSAL 和 CIBERONC,3707 萨拉曼卡,西班牙; lgandullo@usal.es (LG-S.); atanasio@usal.es (AP) 4 卡斯蒂利亚-拉曼恰大学(UCLM)护理学院,02008 阿尔瓦塞特,西班牙 5 西班牙卫生研究所(IdISSC)和圣卡洛斯医院(HCSC)医学肿瘤科实验治疗学部,2040; cnietoj@salud.madrid.org 6 纳瓦拉大学药学与营养学院营养、食品科学与生理学系,31008 潘普洛纳,西班牙 * 通讯地址:alberto.ocana@salud.madrid.org
leimusertib在临床前患者中具有抗肿瘤活性 -
摘要:大肠癌(CRC)是全球与癌症相关死亡的主要原因之一。根据癌症干细胞(CSC)模型,高死亡率与转移性疾病直接相关,被认为是由结肠癌干细胞引发的。因此,早期鉴定那些处于转移高风险的患者对于改善治疗和患者预后至关重要。是一种新型的预后生物标志物,用于肿瘤进展和转移形成,独立于肿瘤阶段。我们先前显示MACC1参与癌症中的MACC1转基因小鼠模型的小鼠肠。但是,MACC1在人CSC中的表达和可能的含义仍然难以捉摸。在这里,我们探索了MACC1根据患者衍生的肿瘤类器官(PDOS),患者衍生的异种移植(PDXS)和人类CRC细胞系调节MACC1调节干性和与CSC相关的侵入性表型的分子机制。我们表明,来自PDO模型的CD44富集的CSC表现出明显更高的MACC1和LGR5水平,并且在免疫功能低下的小鼠中表现出更高的肿瘤性。同样,在PDO和PDX模型上进行的RNA测序显示ALDH1(+)CSC中的MACC1表达显着增加,突出了其参与癌症的参与。我们进一步显示了PDO模型中MACC1与CSC标记CD44,Nanog和LgR5的相关性以及已建立的细胞系。此外,MACC1增加了干细胞基因表达,克隆原性和球体形成。引人注目的是,我们表明MACC1作为转录因子与LGR5基因启动子结合,发现了久远的CSC标记LGR5作为MACC1使用的新型基本信号介质,以诱导人类CRC患者的CSC样性质。我们的体外发现得到了MACC1与CRC细胞系中LGR5的显着正相关以及CRC患者肿瘤的显着正相关。综上所述,这项研究表明转移诱导剂MACC1充当癌症干细胞相关的标记。针对MACC1的介入方法可能会改善结直肠癌患者的进一步靶向疗法,以消除CSC并防止癌症复发和远处转移形成。
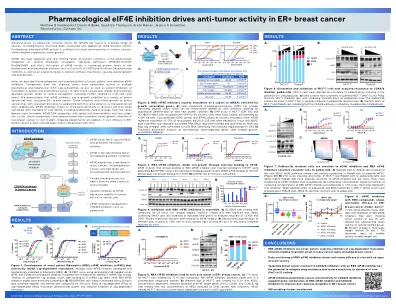
药理学EIF4E抑制作用驱动ER +乳腺癌的抗肿瘤活性
在这里,我们描述了新颖,有效和选择性EIF4E抑制剂的发展和表征。该化学系列的化合物在多种生物化学和生物物理M7G盖帽概要分析中具有纳莫尔活性,并且对细胞和生化测定中的翻译有效抑制。在细胞中,这些化合物迅速和可逆地降低了包括CCND1在内的几种癌基因的蛋白质水平,从而导致G1细胞周期停滞。我们证明了EIF4E抑制剂在包括ER+乳腺癌在内的多种乳腺癌细胞系中引起生长抑制作用。这些抑制剂还抑制具有与父母细胞系相同效力的对palbociclib的耐药性的乳腺癌生长。此外,当与标准护理(SOC)(包括palbociclib)结合使用时,EIF4E抑制作用显示出抗性细胞系的灵敏度增加。从该系列中选择类似物表现出良好的ADMET/PK特性,具有良好的口服生物利用度和低安全风险。最后,这些化合物在体内模型的非胸腺癌中表现出接近完全的肿瘤生长抑制。正在进行的实验将解决单一疗法和与SOC结合的ER+乳腺癌的体内功效。
多酚是针对癌症驾驶信号通路主要参与者的抗肿瘤剂
多酚构成了一群重要的天然产物,传统上与广泛的生物活性相关。这些通常在天然产物中以低浓度发现,现在可以在营养或饮食补充剂中找到。一组包括阿彭素,槲皮素,姜黄素,白藜芦醇,EGCG和Kaempferol在内的多酚可以调节癌症发展,进展和转移的核心信号通路。在这里,我们描述了这组多酚对影响癌症的信号通路的关键元素的影响的新型机械见解。我们描述了这些多酚诱导的蛋白质修饰及其对包括PI3K,AKT,MTOR,RAS和MAPK在内的几种信号通路的中心元素的影响,尤其是影响肿瘤抑制p53蛋白的蛋白质。调节p53基因表达和蛋白质水平以及翻译后的修饰,例如磷酸化,乙酰化和泛素化,从而受到磷酸化,乙酰化和泛素化的影响,从而影响p53,这些转换靶标的亚细胞稳定性,亚细胞位置,新的转录靶标的激活以及p53的新作用p53响应p53的作用,衰老和细胞命运。因此,对多酚对这些主要参与者的影响 - 驱动信号传导途径的影响肯定会导致设计更好的靶向疗法,并且对癌症治疗的毒性较小。本综述的范围集中于研究最多的多酚对癌症信号通路的关键要素的调节,并强调了对这些法规深刻理解的重要性,以改善天然产物的癌症治疗和控制。
综述基于肿瘤内药物输送的抗肿瘤治疗策略的发展
摘要:近几十年来,对疗效显著、副作用较小的肿瘤治疗的研究得到了广泛的开展,不同剂型的药物受到了广泛的关注,但其全身生物分布存在疗效和安全性问题。肿瘤内给药因其在肿瘤内富集和滞留性好,有望克服这些问题,从而减少副作用。将水凝胶、纳米颗粒、微针和微球等药物载体直接输送到肿瘤,不仅可以实现肿瘤的靶向治疗,而且副作用小。此外,肿瘤内给药已与化疗、增强放疗、免疫治疗、光疗、磁流体热疗和多模态治疗等治疗策略相结合,其中一些策略正在进行临床试验或已应用于临床。然而,肿瘤胶原纤维阻碍药物渗透,高密度高压挤出药物,肿瘤内注射技术不成熟等诸多障碍阻碍了肿瘤内给药成为一种理想且广泛应用的选择。在本综述中,我们系统地讨论了不同药物载体的肿瘤内输送以及肿瘤内治疗策略的当前发展。关键词:肿瘤内给药,药物载体,治疗策略,抗肿瘤治疗
共价蛋白作为靶向放射性核素疗法增强抗肿瘤作用
摘要:分子靶向放射性核素疗法 (TRT) 难以平衡疗效和安全性,因为目前增加肿瘤吸收的策略通常会改变药物药代动力学以延长血液循环和正常组织照射时间。我们在此报告了第一个共价蛋白 TRT,它通过与靶标发生不可逆反应,增加了肿瘤的放射性剂量,而不会改变药物的药代动力学特征或正常组织的生物分布。通过遗传密码扩展,我们将潜在的生物反应性氨基酸设计成纳米抗体,该抗体与其靶蛋白结合并通过邻近反应形成共价键,在体外、癌细胞和体内肿瘤上不可逆地交联靶标。放射性标记的共价纳米抗体显着增加了肿瘤中的放射性同位素水平并延长了肿瘤的停留时间,同时保持了快速的全身清除。此外,与 α 发射体锕-225 结合的共价纳米抗体比非共价纳米抗体更有效地抑制肿瘤生长,而不会引起组织毒性。这种化学策略将基于蛋白质的 TRT 从非共价模式转变为共价模式,改善了肿瘤对 TRT 的反应,并且可以很容易地扩展到针对广泛肿瘤靶点的多种蛋白质放射性药物。■ 简介