XiaoMi-AI文件搜索系统
World File Search System急性淋巴细胞白血病儿童的腹泻
急性淋巴细胞白血病(全部)是儿童中最普遍的癌症。婴儿和2岁以下的幼儿接受所有治疗的治疗经常表现出受损的适应性反应,从而增加了他们对感染的敏感性,并长时间的病原体排泄。这可能会引发一系列并发症,包括吸收不良,未能繁殖和化学疗法的破坏,从而导致管理疾病的挑战(1,2)。在2018年,印度尼西亚的儿童人口为7950万,急性淋巴细胞白血病的年发病率估计约为3,434例新病例。在全球范围内,发病率是可比的,尽管在低收入国家可能较低。系统审查报告的发病率为每10万名儿童4.32。遗传易感性,例如唐氏综合症和先天性免疫缺陷,例如Wiskott-Aldrich综合征,与发展急性淋巴细胞白血病(ALL)的较高风险有关,尽管大多数情况没有可识别的原因。在1-4岁的儿童中,所有发生率最高的发生率最高,男性比女性更频繁,男女比率约为1.5:1。尽管仍在研究特定的环境风险因素,但某些化学物质或辐射的暴露可能会增加患白血病的可能性(3)。
BC Cancer 使用 Zanubrutinib 治疗慢性淋巴细胞白血病或小淋巴细胞淋巴瘤的方案摘要
1.中性粒细胞减少症:如有发热或其他感染迹象,必须及时评估并积极治疗。2.出血事件:接受 zanubrutinib 治疗的患者中约有一半会发生轻微出血事件,包括瘀伤、鼻出血和瘀点。1% 至 4% 的患者会发生严重出血事件(严重或 3 级或更高出血)。正在服用抗凝剂或抑制血小板功能药物的患者应慎用。手术前后 3 至 7 天暂停治疗;根据出血风险决定术后是否重新开始用药。3.感染:zanubrutinib 治疗期间经常报告细菌、病毒、真菌和机会性感染。约 20% 的报告感染与并发中性粒细胞减少症有关。2.5% 的患者报告了致命感染。对于感染风险较高的患者,应考虑预防性用药,并适当管理感染。 4. 第二原发性恶性肿瘤:接受 zanubrutinib 治疗的患者中,已有严重及致命性恶性肿瘤的报道。皮肤癌是最常见的第二原发性恶性肿瘤,9% 的患者报告了该病,包括基底细胞癌、鳞状细胞癌和恶性黑色素瘤。应监测可疑皮肤病变的出现,并建议患者采取适当的防晒措施。5. 药物相互作用:zanubrutinib 是 CYP3A4 的底物。与强效或中效 CYP 3A4 抑制剂合用可能会增加 zanubrutinib 的暴露量;应尽可能避免。同时使用 zanubrutinib 时可能需要减少剂量。zanubrutinib 与强效 CYP 3A4 诱导剂合用可能会降低 zanubrutinib 的暴露量;应尽可能避免。更多信息,包括常见药物相互作用的剂量减少指导,请参阅《癌症药物手册》。 6. 服用布鲁顿酪氨酸激酶 (BTK) 抑制剂的患者中,已有高血压报告。每次就诊时都应测量血压,如果出现高血压,应立即治疗。高血压会增加 BTK 抑制剂治疗中心脏并发症的风险。7. 据报道,使用 zanubrutinib 的患者可能会出现心房颤动和心房扑动;有心脏危险因素、高血压或急性感染的患者,风险可能会增加。8. 淋巴细胞增多症:据报道,在开始使用 zanubrutinib 治疗时,可能会出现淋巴细胞增多症。研究中,淋巴细胞增多症的中位发病时间为 4 周,淋巴细胞增多症的中位持续时间为 8 周。无症状淋巴细胞增多症的患者应继续使用 zanubrutinib 治疗。9. 间质性肺病 (ILD):据报道,在 zanubrutinib 治疗期间,患者可能会出现 ILD 的体征和症状。应监测患者是否出现 ILD 的体征和症状。如果疑似 ILD,请暂停治疗。如果确诊 ILD,则应停止治疗。 10. 肝功能损害:重度肝功能损害患者,请将赞布替尼剂量减至每日两次,每次80毫克。监测不良反应。轻度或中度肝功能损害患者无需调整剂量。监测毒性。11. 乙肝病毒复发:更多详情,请参阅 SCHBV 方案。如有任何关于此治疗方案的问题或疑问,请致电 Alina Gerrie 医生或肿瘤组代表 (604) 877-6000 或 1-800-663-3333。
淋巴细胞绒毛膜炎病毒(LCMV)
每次怀孕的始于3-5%的出生缺陷的机会。这称为背景风险。如果妇女在怀孕期间获得LCMV,则该病毒可以传递给发育中的胎儿。这称为先天性LCMV。先天性LCMV最常见的先天缺陷是大脑中的流体(脑积水/心室肿瘤),头部大小(微脑大小)是大脑(小脑)的一部分(小脑),它并未完全发育,或者不应小于脑(小脑腹膜下脑降低)和/或眼睛的损失(可能会导致),并且会导致造成(CHOR)。LCMV也可能导致胎儿周围的流体积聚(水力流)。
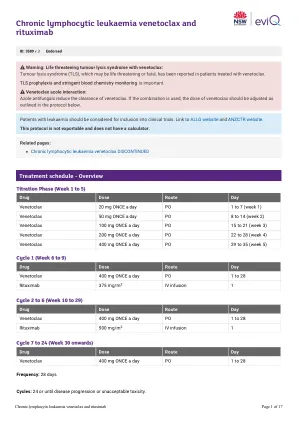
慢性淋巴细胞白血病Venetoclax和Rituximab
剂量修改的证据是有限的,EVIQ提出的建议仅作为指导。他们通常是保守的,重点是安全。任何剂量修改均应基于临床判断,以及个体患者的状况,包括但不限于治疗意图(治愈性与姑息治疗),抗癌治疗方案(单一对组合疗法与化学疗法与化学疗法与免疫疗法),癌症的生物学,癌症,大小,突变,转移酶的其他副作用,良好的效果,表现良好,效果和其他副作用,表现为其他。修改基于临床试验结果,产品信息,已发表的指南和参考委员会共识。降低剂量适用于每个单独剂量,除非另有说明,否则不适用于治疗周期的总天数或持续时间。非血液学等级基于不良事件的共同术语标准(CTCAE),除非另有说明。肾脏和肝剂量修饰已在可能的情况下进行标准化。有关更多信息,请参见剂量注意事项和免责声明。
慢性淋巴细胞白血病患者的感染
新诊断的 CLL 患者具有固有的免疫缺陷,使他们容易感染,包括低丙种球蛋白血症、T 细胞缺陷、抑制性自然杀伤细胞、树突状细胞、中性粒细胞和补体系统。5 低丙种球蛋白血症是与严重感染风险增加相关的主要免疫缺陷,如果血清 IgG 水平低于 600 mg/dL,风险会增加 5 倍。6 然而,血清免疫球蛋白水平与感染之间并不总是存在明确的相关性,血清免疫球蛋白水平正常的患者可能会复发感染。7 血清免疫球蛋白水平很少会随着治疗恢复到正常值,尽管一项研究报告称,成功使用伊布替尼治疗的患者的血清 IgA 水平有所升高。8
儿童急性淋巴细胞白血病 div>
骨髓中的造血干细胞是产生各种血细胞在内的重要部分,包括红细胞,白细胞和血小板。在急性白血病患者中,异常的爆炸细胞被取代这些正常细胞,并且不能发展为成熟的血细胞,并结合了异常细胞的增加,导致普通血细胞失败。因此,白血病患者经历了与骨髓衰竭有关的症状和体征,包括减少红细胞或血红蛋白的慢性疲劳,白细胞降低或血小板下降异常出血而受到异常出血。这些患者可能会因异常细胞的不受控制的扩张而遭受骨痛。他们可能会出现纵隔肿块(胸部肿块),并且可能会出现呼吸道症状,例如呼吸困难,呼吸急促或心血管症状,例如COM Pression中的脸部和颈部肿胀。其他非特异性症状包括食欲不振或体重减轻。
慢性淋巴细胞白血病脑浸润
虽然早期的尸检研究表明 71% 的慢性淋巴细胞白血病 (CLL) 患者中枢神经系统受累,但活体受累的情况很少见。一名 72 岁的男性患有未经治疗的、症状轻微的 CLL,出现亚急性发作性脑病,并出现严重的低钠血症和应激性心肌病。他最初的头部计算机断层扫描没有异常。经过仔细的钠校正后,他的精神状态并没有改善。脑部磁共振成像最终显示整个大脑半球、脑干和小脑广泛存在 T2 高强度信号。脑脊液分析显示总有核细胞增多(31/mcL,89% 淋巴细胞),蛋白质为 75 mg/dL,聚合酶链反应检测人类疱疹病毒 6 阳性,并存在恶性 CD5+ B 细胞,符合 CLL 的表现。脑活检证实 CLL 细胞直接浸润脑实质。他开始服用 zanubrutinib,临床和放射学症状有所改善。他的神经系统恢复仍然缓慢,他的家人选择过渡到以舒适为重点的护理。我们患者的病例代表了一种罕见的神经系统表现,影响不到 1% 的 CLL 患者。尽管 zanubrutinib 有部分临床和放射学反应,但他的预后不佳,可能是因为 CLL 涉及的脑区广泛。
小淋巴细胞淋巴瘤:复发/难治性
随着口服靶向疗法的发展,CLL/SLL的自然史(疾病如何发展)发生了巨大变化(口服靶向疗法的药物(靶向特定分子)癌细胞用于生长和/或扩散的药物)。许多CLL/ SLL患者在诊断时不需要治疗,并通过几个月到几年的积极监视进行监测。在这种情况下,除非出现症状,否则请密切监测患者的病情,但未治疗,或者疾病恶化。其他CLL/SLL患者应对初始治疗并缓解(体征和症状消失)。在某些情况下,癌症会变得难治性(停止对治疗反应)或复发(治疗后疾病恢复)。对于疾病复发或难治性的患者,不同的疗法可能会改善结局和缓解。但是,大多数CLL/SLL患者对治疗和难治性疾病有反应。但是,大多数CLL/SLL患者对治疗和难治性疾病有反应。
慢性淋巴细胞白血病的靶向治疗
摘要:在慢性淋巴细胞白血病 (CLL) 中,对疾病生物学的深入了解导致过去十年来开发和临床使用不同的靶向药物,包括布鲁顿酪氨酸激酶 (BTK) 抑制剂。第一个获准用于临床的 BTK 抑制剂是伊布替尼,它表现出优异的疗效和良好的耐受性。最近,人们对新型更具选择性的 BTK 抑制剂的兴趣日益浓厚,这种抑制剂可以减少药物的脱靶效应,从而最大限度地减少副作用和随后的治疗中断或停止。阿卡替尼是一种口服不可逆的 BTK 抑制剂,其特点是对其他激酶没有抑制作用。在这篇综述中,我们介绍了阿卡替尼和基于阿卡替尼的联合治疗对复发/难治性和初治 CLL 患者的临床疗效的临床试验最新数据。我们描述了该药物的安全性,描述了感兴趣的副作用,并讨论了接受阿卡替尼治疗的患者的临床管理。由于其疗效和良好的安全性,阿卡替尼已成为当前多种获批的 CLL 治疗方案中的一种可行治疗选择。关键词:慢性淋巴细胞白血病、阿卡替尼、布鲁顿酪氨酸激酶抑制剂
急性淋巴细胞白血病的靶向治疗
摘要:过去十年,我们对急性淋巴细胞白血病 (ALL) 的各种遗传病变的理解有了重大飞跃。下一代测序已导致识别出对预后具有重大影响的驱动突变,并定义了 BCR-ABL 样 ALL 等实体,其中酪氨酸激酶抑制剂 (TKI) 和 JAK 抑制剂等靶向疗法可能在其治疗中发挥作用。在费城阳性 ALL 中,将 TKI 引入一线治疗方案已经改变了患者的治疗结果。在 B-ALL 中,针对表面受体 CD19、CD20 和 CD22 的药物,包括单克隆抗体、双特异性 T 细胞接合剂、抗体药物偶联物和嵌合抗原受体 (CAR) T 细胞,已显示出显着的活性,但具有独特的毒性,并对治疗顺序产生影响。T-ALL 的进展落后于 B-ALL 的进展。然而,奈拉滨、硼替佐米和 CAR-T 细胞疗法等靶向 T 细胞抗原的药物已被研究,并取得了令人鼓舞的结果。随着我们对 ALL 疾病生物学的了解不断加深,我们通过 BH3 模拟物、趋化因子和表观遗传调节剂靶向凋亡等途径的能力也在不断增强。本综述旨在重点介绍 ALL 中一系列现有和新兴的靶向疗法,探索其作用机制并讨论其使用的当前证据。