XiaoMi-AI文件搜索系统
World File Search System2025 年 Hanna H. Gray 研究员计划竞赛 成功科学研究提案示例
摘要 mTORC1 蛋白激酶响应各种输入(包括氨基酸)调节细胞生长,这些输入向 Rag GTPases 发出信号,促进 mTORC1 易位到溶酶体表面(其激活位点)。这种途径在许多疾病中失调,包括糖尿病和癌症;然而,我们对氨基酸激活 mTORC1 的机制的理解并不完整。长期以来,一个谜团是氨基酸缺乏时抑制 mTORC1 的成分的身份。作为一名研究生,我推断负调节剂可能会影响 Rags,因为它们在营养感知中起着核心作用。我们对 Rags 进行了免疫沉淀,然后进行质谱分析 (IP/MS),结果发现了两个相互作用的蛋白质复合物,我们称之为 GATOR1 和 GATOR2。GATOR2 正向调节 mTORC1 并在 GATOR1 上游或与 GATOR1 并行发挥作用,GATOR1 是一种 Rag GTPase 激活蛋白,也是 mTORC1 的关键抑制剂。 GATOR1 成分在癌症中发生突变,可能有助于识别对 mTORC1 抑制有反应的癌症。第二个未解之谜是 mTORC1 上游氨基酸传感器的身份。为了识别假定的传感器,我们对已知的 mTORC1 调节剂进行了广泛的 IP/MS。我们发现 Sestrin2 和 CASTOR1 是与 GATOR2 相互作用的蛋白质,分别起到亮氨酸和精氨酸传感器的作用。Sestrin2 和 CASTOR1 与 GATOR2 结合以抑制 mTORC1,并且在存在氨基酸的情况下这种抑制会得到缓解。重要的是,这些传感器的氨基酸结合能力是 mTORC1 感知氨基酸存在所必需的。总之,这些成分的发现澄清了我们对氨基酸如何向 mTORC1 发出信号的理解,并提供了在疾病状态下调节 mTORC1 活性的目标。
癌症治疗中的生物疗法 - 武器和新方向
摘要:生物学疗法通过靶向癌细胞的同时减少对正常组织的影响,改变了肿瘤学的面貌。本出版物主要集中于为治疗某些恶性肿瘤的进展而贡献的新疗法。免疫疗法反复被证明是黑色素瘤的突破性疗法,以及对CAR T细胞的B-All治疗,在这一进展中具有很高的优点。这些疗法目前是通过修饰双剂抗体和CAR T细胞来提高其效率和生物利用度来开发的。在改善溶瘤病毒治疗方面的努力也正在发展,并且正在努力改善癌症疫苗的免疫统一性和稳定性。将各种生物疗法,免疫疗法与溶瘤病毒或癌症疫苗结合在一起,在癌症治疗中变得重要。新的治疗靶标是未经免疫功能低下的新抗原或与肿瘤基质细胞相关的抗原的强烈寻求的。一个例子是纤维细胞激活蛋白α(FAPα),在肿瘤进展的情况下观察到了其过度的压力。通用治疗靶标,例如神经营养受体酪氨酸激酶(NTRK)基因融合,这是许多类型的癌症中存在的关键遗传驱动因素。本综述还提出了肿瘤微环境的问题。基质细胞可以保护肿瘤细胞免受化学疗法的影响,并有助于复发和进展。该出版物还解决了癌症干细胞对治疗的耐药性的问题,并提出了避免这种现象的试图。本综述着重于提高生物疗法选择性的最重要策略。
G4分解DHX36具有预后的意义,并通过非小细胞肺癌的多种因果法规发挥肿瘤抑制功能
肺癌是全球男女最普遍的癌症之一。核酸G4结构已与某些癌症(例如肺癌)的癌症相关基因的转录程序有关。然而,主要的G4分解DHX36在肺癌进展中的作用尚不清楚。在这项研究中,通过对公共数据集的生物信息学分析(TCGA和GEO),我们发现DHX36是具有亚型依赖性的非小细胞肺癌(NSCLC)的独立预后指标。DHX36的稳定慢病毒敲低导致肺癌细胞中S期亚群的加速迁移和聚集。DHX36水平的降低消除了肺癌细胞对化学治疗药物(如紫杉醇和细胞依赖性)的增殖反应。该解旋酶的敲低导致肿瘤生长,这是由3D荧光球体肺癌模型所证明的,并且刺激细胞集落形成,如单细胞培养所示。高吞吐量蛋白质组学阵列表明,DHX36通过调节多种信号传导途径在肺癌细胞中的功能,包括蛋白质活性的激活,蛋白质自体磷酸化,FC受体信号信号通路,对肽激素激活的蛋白质激活蛋白蛋白激酶信号助理的反应。因果转录组分析表明,DHX36与mRNA监视,RNA降解,DNA复制和MYC靶标显着相关。因此,我们公布DHX36提出了临床意义,并在肺癌的肿瘤抑制中起作用,并提出了基于解旋酶特异性靶标的抗癌治疗的潜在新概念。
与预后和免疫浸润相关的草药配方的研究文章机制:转录组学分析和分子动态
背景。这项研究的目的是探索使用系统生物学方法的草药配方单体与其治疗靶标之间的相互作用,这可能是揭示其潜在机制的一种有希望的方法。shentao ruangan汤(Strgd)。方法。从传统的中药系统药理学数据库和分析平台和蝙蝠侠-TCM数据库中检索了StrGD的生物活性成分和药物靶标。LIHC相关的差异分歧基因(DEGS)和关键模块。te kaplan – Meier分析用于研究StrGD肿瘤靶标与患者存活之间的关系。te cibersort反卷积算法用于分析StrGD肿瘤靶标与内部免疫细胞之间的相关性。富集分析用于分析生物学功能。使用分子对接和MDS研究了StrGD化合物与LIHC-免疫相关基因之间的相互作用。结果。我们确定了24个StrGD肿瘤靶标,这与LIHC患者的生存和免疫细胞水平相关。免疫纤维化,基因集富集和基因和基因组分析的京都百科全书强调了T和B细胞亚群的作用,这些作用均与激活蛋白1(AP1)有关,在StrGD动作中都相关。结论。对接研究和HPLC表明,坦(Tanshinone IIA)是LIHC治疗中StrGD的主要化合物,MDS表明潜在的LIHC免疫相关靶标1FOS和1Junly与Tanshinone IIA结合。TE机制包括StrGD化合物与LIHC免疫相关靶标之间的相互作用。这项研究的发现可以指导研究研究研究对靶向1Jun和1fos治疗LIHC的药物的潜在有用性的研究。
档案中的库弗特·Unige疫苗在护理中犹豫...
受体。ms4a4a是一种四翼烷分子,在分化和极化过程中,在巨噬细胞中选择性表达,对于自然杀伤细胞介导的转移抗性的dectin-1依赖性激活必不可少。它的激活与各种病理有关,包括与人类的系统性硬化相关的肺纤维化。[1] 8.80 0.033 TBC1D4 TBC1域家族,成员4可以充当Rab2a,Rab8a,Rab10和Rab14的GTPase激活蛋白。同工型2促进胰岛素诱导的葡萄糖转运蛋白转运蛋白SLC2A4/GLUT4在质膜上的易位,从而增加了葡萄糖摄取。 [2] 4.99 0.018 LTB淋巴毒素B细胞因子与LTBR/TNFRSF3结合。 可能在免疫反应调节中发挥特定作用。 [3] 4.85 0.038 TLR8 TOLL样受体8内体受体,在先天和适应性免疫中起关键作用。 其对下游转录因子NF-KAPPA-B和IRF7的激活诱导促炎性细胞因子和干扰素产生。 [4] 4.02 0.043 AKR1B8 Aldo-Keto还原酶家族1,成员B8同工型2促进胰岛素诱导的葡萄糖转运蛋白转运蛋白SLC2A4/GLUT4在质膜上的易位,从而增加了葡萄糖摄取。[2] 4.99 0.018 LTB淋巴毒素B细胞因子与LTBR/TNFRSF3结合。可能在免疫反应调节中发挥特定作用。[3] 4.85 0.038 TLR8 TOLL样受体8内体受体,在先天和适应性免疫中起关键作用。其对下游转录因子NF-KAPPA-B和IRF7的激活诱导促炎性细胞因子和干扰素产生。[4] 4.02 0.043 AKR1B8 Aldo-Keto还原酶家族1,成员B8
国际过敏性
背景:选择性激活蛋白(AP)-1抑制剂是特应性皮炎(AD)的潜在有前途的治疗剂,因为AP-1是皮肤炎症的重要调节剂。然而,很少有研究研究了AP-1抑制剂在治疗炎症性皮肤疾病中的局部应用。方法:进行免疫组织化学以检测AD患者皮肤病变的磷酸化AP-1/C-JUN表达。在体内研究中,将1%T-5224软膏局部应用于2,4二硝基氟苯挑战的AD类皮炎模型小鼠的耳朵。Bariticinib是一种常规的治疗剂Janus激酶(JAK)抑制剂,也被局部应用。在体外研究中,用T-5224处理人表皮角质形成细胞,并用AD相关的细胞因子刺激。结果:AP-1/C-JUN在AD患者的皮肤病变处磷酸化。在体内,局部T-5224应用抑制了耳朵肿胀(P <0.001),恢复纤维蛋白(FLG)表达(P <0.01),并且通常抑制了与免疫相关的途径。T-5224显着抑制了IL17A和L17F表达,而Baricitibinib则没有。bariticinib抑制了IL4,IL19,IL33和IFNB表达,而T-5224没有。IL1A,IL1B,IL23A,IFNA,S100A8和S100A9表达在联合使用T-5224和Bariticinib之后,协同下调。在体外,T-5224恢复了FLG和Loricrin(Lor)(P <0.05)的表达,并抑制IL33表达(P <0.05),而不会影响细胞的活力和细胞毒性。通过与JAK抑制剂联合使用来扩增该抑制剂的效果。结论:局部T-5224改善小鼠AD样皮炎的临床表现。©2024日本过敏症学会。由Elsevier B.V.这是CC BY-NC-ND许可证(http://creativecommons.org/licenses/by-nc-nd/4.0/)下的开放访问文章。
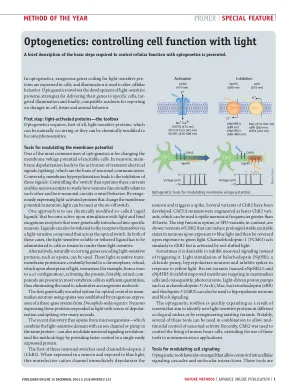
光遗传学:用光控制细胞功能
调节膜电位的工具 光遗传学最常见的用途之一是改变可兴奋细胞的膜电位。在神经元中,膜去极化会导致瞬态电信号(脉冲)的激活,这是神经元通讯的基础。相反,膜超极化会导致这些信号的抑制。控制操作这些电流的“开关”使神经科学家能够研究神经元在功能上如何相互关联以及神经元回路如何控制行为。通过外源表达改变神经元膜电位的光激活蛋白,光可以用作开关。一种方法是使用化学修饰的所谓“笼状配体”,这些配体在光刺激下变得活跃并与通过基因引入特定神经元的外源性受体结合。配体也可以通过充当光开关的光敏化合物与受体本身相连。在这两种情况下,都必须将光敏的可溶性或束缚配体注入细胞或组织,使它们对光敏感。或者,可以使用编码光敏蛋白(如视蛋白)的天然基因。这些光敏跨膜蛋白与发色团视网膜共价结合,视网膜吸收光后发生异构化(例如,从反式变为顺式构型),从而激活蛋白质。值得注意的是,视网膜化合物在大多数脊椎动物细胞中含量充足,因此无需注入外源分子。第一个利用视蛋白进行哺乳动物神经元光学控制的遗传编码系统是通过外源表达果蝇的三基因系统建立的。表达这些蛋白质的神经元对光的反应是数秒内的去极化和尖峰波。最近发现,微生物中的视蛋白(将光敏域与同一蛋白质中的离子通道或泵相结合)也可以调节神经元信号,通过在单个易于表达的蛋白质中提供更快的控制,彻底改变了该方法。这些神经元开关中的第一个使用了通道视紫红质-2 (ChR2)。当在神经元中表达并暴露于蓝光时,这种非选择性阳离子通道会立即使神经元去极化
TCP家族的全基因组表征及其在燕麦的非生物应激抗性中的潜在作用(Avena sativa L.)
目的:神经炎症是响应中枢神经系统(CNS)损伤,感染,毒素刺激或自身免疫性而发生的。我们先前在脂多糖(LPS)刺激下分析了HT22细胞(小鼠海马神经元)的下游分子变化。我们检测到纤维化蛋白(FBL)的表达升高,这是一种核仁甲基转移酶,但相关的促炎机制未被系统地阐明。这项研究的目的是研究FBL影响神经炎症的潜在机制。方法:使用RT实时PCR,蛋白质印迹和免疫荧光来评估用LPS刺激的HT22细胞中FBL的mRNA和蛋白质表达,以及FBL的细胞定位和荧光强度。Bay-293(七个无同源物1(SOS1)抑制剂的儿子),SR11302(激活蛋白-1(AP-1)抑制剂)和KRA-533(KRAS激动剂)用于确定FBL效果的潜在的分子机制。ap-1是FBL的靶蛋白,并用T-5224(AP-1抑制剂)进行验证。另外,通过转录组测序鉴定了FBL的下游信号通路,并通过RT-real-eal-time PCR验证。结果:LPS在HT22细胞中诱导FBL mRNA和蛋白质表达。深入的机械研究表明,当我们抑制C-FOS,AP-1和SOS1时,FBL表达降低,而当使用KRAS激动剂时,FBL表达会增加。本研究揭示了FBL促进神经炎症的机制,并为治疗神经炎症提供了潜在的靶标。此外,在FBL过表达后,将NF-KB信号通路中炎症基因的转录水平(包括CD14,MyD88,TNF,TRADD和NFKB1)升高。结论:LPS通过RAS/MAPK信号通路诱导HT22细胞中FBL的表达,FBL进一步激活了NF-KB信号通路,从而促进了相关炎症基因的表达和细胞因子的释放。关键字:FBL,神经炎症,LPS,分子对接,转录组测序
使用68GA/177LU-DOTA
抽象的背景成纤维细胞激活蛋白(FAP)靶向的放射性疗法具有免疫调节作用,在临床前和临床研究中都显示出有效性。我们最近报道了一种新型的二聚体FAP靶向放射性药物,68 GA/ 177 LU-DOTA-2P(FAPI)2,该2P(FAPI)2显示了各种癌症中肿瘤的吸收和延长保留率的增加。然而,需要进一步探索才能了解结合68 GA/ 177 lu-dota-2p(FAPI)的治疗功效和潜在机制。关于放射性药物诱导的PD-L1表达和DNA双链断裂的变化,CT26-FAP肿瘤细胞分别与68 GA和177 LU标记的DOTA-2P(FAPI)2孵育。Monotherapy with 68 Ga-DOTA-2P(FAPI) 2 , 177 Lu-DOTA-2P(FAPI) 2 , and PD-L1 immunotherapy as well as combination therapy ( 68 Ga/ 177 Lu-DOTA-2P(FAPI) 2 and PD-L1 immunotherapy) were tested and evaluated to evaluate in vivo antitumor efficacy.此外,还使用免疫组织化学染色和单细胞RNA测序来分析肿瘤微环境(TME)的变化,并阐明了这种组合疗法的基本作用机制。结果我们的发现表明,靶向FAP的放射性药物可以诱导DNA双链断裂并上调PD-L1表达,而177 Lu-Dota-2p(FAPI)2证明比68 Ga-Dota-2p(FAPI)2更有效。与抗PD-L1单克隆抗体(αPD-L1 MAB)结合使用时,68 GA-DOTA-2P(FAPI)2和177 LU-DOTA-2P(FAPI)2放射性药物可显着改善治疗结果。值得注意的是,在小鼠模型中,177 LU-DOTA-2P(FAPI)2与αPD-L1 MAB免疫疗法的组合消除了肿瘤。用该方案治疗的小鼠不仅对初始免疫检查点抑制剂治疗表现出异常反应,而且还显示出对随后的肿瘤细胞重新接种的100%肿瘤排斥。进一步的机械研究表明,与αPD-L1 mAb结合使用的177 Lu-Dota-2p(FAPI)2可以重新编程TME,从而增强了抗肿瘤间交流,从而激活
RHOGDI2在免疫和癌症中的双重功能
Rho GTPases是RAS超家族的高度保守成员,最著名的是组织肌动蛋白和微管细胞骨架,从而定义细胞的形状和迁移。他们还控制着各种各样的信号通路,这些信号通路可以调节关键的生物学过程,例如囊泡转运,细胞分裂和基因转录[1-3]。Rho GTPases循环在活动的GTP结合形式和不活动的GDP结合形式之间。该活性受三类蛋白质的调节:鸟嘌呤核苷酸交换因子(GEFS)催化GDP的GDP交换为GTP激活GTPase;而GTPase激活蛋白(GAP)会增加GTPase的内在GTP水解速率并使IT失活;和鸟嘌呤核苷酸解离抑制剂(GDIS)隔离了细胞质中GDP结合的GDP结合形式,以防止GEFS或泛素介导的脱脂剂激活它们(图1)[4]。Rho GTPases及其调节剂的异常信号传导通常在许多人类癌症中发现,并且归因于几种机制[5-10]。到目前为止,已经确定了将近20个Rho GTPase家族成员的近85个Rhogefs和66个Rhogaps,其中,到目前为止,只有3个人Rhogdis已确定:rhogdi1(或Rhogdiα),Rhogdiα),Rhogdi2i2(或Rhogdiβ或rhogdiβ或ly d4-gdi)(或rhogdiβ或ly d4-gdi) γ)[8]。这三个仅驻留在细胞质中,其中rhogdi1被普遍表达[11,12]。rhoGDI2最初被认为在造血细胞中特异性表达[13,14],但随后在包括癌细胞在内的其他各种细胞类型和组织中也发现了[8]。最后,rhogdi3主要在靶向高尔基体的大脑,肺,肾脏,睾丸和胰腺中表达,并将特异性朝向RHOB和RHOG [15]。对癌症和免疫力中的RhoGDI3不太了解,因此在本综述中不会进一步讨论。rhogdi1和rhogdi2通过参与癌细胞迁移,侵袭和转移与多种人类癌症有关,因此被认为是癌症生物学的有吸引力的靶标[8]。rhogdi2由于其较低的丰富性和更限制的分布而在很大程度上保留在Rhogdi1的阴影中。但是,由于发现Rhogdi2可能在多种人类癌症和许多关键的细胞过程中起更复杂的作用,因此开始引起更多的关注。本评论重点介绍了Rhogdi1和Rhogdi2之间的相似性和差异,同时还封装了后者所显示或已提出扮演的多个角色。