XiaoMi-AI文件搜索系统
World File Search System周细胞是器官特异性的组织调节器......
血管提供了一种多功能且适应性强的运输系统,但最近的研究已经证实,构成血管网络最内层的内皮细胞也是控制周围组织中其他细胞类型行为的分子信号来源。周细胞是血管壁的另一个重要组成部分,但人们对它们在器官生长和模式形成过程中与其他细胞群的信号相互作用知之甚少。在这里,我们使用组织特异性和可诱导小鼠遗传学、高分辨率成像、单细胞 RNA 测序和细胞培养实验来解决三种周细胞衍生的生长因子在两种模型器官(即肺和脑)的出生后发育中的作用。我们发现 Pdgfrb-CreERT2 控制的肝细胞生长因子 (HGF) 基因失活不会导致出生后大脑发生明显改变,但由于与 AT2 上皮细胞的相互作用缺陷,会损害肺泡形成。同样,周细胞表达脑源性神经营养因子 (BDNF) 不是出生后大脑所必需的,但通过与肺内皮细胞中的受体酪氨酸激酶 TrkB 相互作用来控制肺部发育。相反,周细胞表达 TGFβ 家族生长因子 Nodal 不是肺形态形成所必需的,但调节出生后大脑的血管生长和屏障功能,我们将其归因于与内皮细胞、星形胶质细胞和小胶质细胞的信号相互作用。总之,我们的研究结果表明,周细胞是血管分泌信号的重要来源,这些信号以器官特异性方式控制形态形成过程。
多囊卵巢综合征基于干细胞的疗法
缩写:ADSC,脂肪衍生的干细胞; AFSCs, amniotic fluid stem cells; AMH,抗毛刺激素; BMSC,骨髓基质细胞; CC,积云; CDC2,细胞分裂控制2; CTGF,结缔组织生长因子; DHEA,脱氢雌激素; E2,雌二醇2; Exo,外泌体; FGF2,成纤维细胞生长因子2; FSH, follicular stimulating hormonel; GADD45B,生长停滞和DNA损伤诱导β; IL-1B,白介素1 beta; LH,黄体激素; menscs,月经血液衍生的间充质干细胞; MSC,间充质干细胞; MSC-EV,间充质干细胞衍生的细胞外囊泡; OSC,卵巢干细胞; PCOS,多囊卵巢综合征; VEGF,血管内皮生长因子; VSEL,非常小的胚胎样干细胞; TNFα,肿瘤坏死因子α; UC-MSCs, umbilical cord mesenchymal stem cells
癌症治疗与运动不耐受
ALL = 急性淋巴细胞白血病;AML = 急性髓细胞白血病;BTK = 布鲁顿酪氨酸激酶;CAR = 嵌合抗原受体;CLL = 慢性淋巴细胞白血病;CML = 慢性髓细胞白血病;CNS = 中枢神经系统;CRC = 结直肠癌;EGFR = 表皮生长因子受体;GIST = 胃肠道间质瘤;HCC = 肝细胞癌;HIF-2a = 缺氧诱导转录因子 2a;HL = 霍奇金淋巴瘤;HTN = 高血压;IFN = 干扰素;IL = 白细胞介素;MDS = 骨髓增生异常综合征;MM = 多发性骨髓瘤;MPN = 骨髓增生性肿瘤;NHL = 非霍奇金淋巴瘤; NSCLC = 非小细胞肺癌;RCC = 肾细胞癌;SCLC = 小细胞肺癌;TKI = 酪氨酸激酶抑制剂;VEGF = 血管内皮生长因子;VEGFR = 血管内皮生长因子受体。
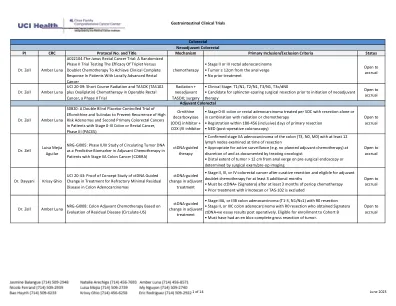
胃肠道临床试验PI CRC方案编号和...
•通过基于组织的分析进行了记录的RAS状态(突变体或WT)•没有微卫星不稳定性高(MSI-HIGH)或不匹配修复缺陷(DMMR)CRC•已接受以下SOC抗癌治疗,作为转移性CRC的先前疗法,并且在射线仪上有射面上的进展,是雷神的,是避免了这些恐怖分子的恐怖分子。a。系统性SOC抗癌疗法必须包括以下所有药物:i。氟嘧啶,伊立替康和奥沙利铂,有或没有抗血管内皮生长因子(VEGF)单克隆抗体(例如,贝伐单抗)II。抗发育生长因子受体(EGFR)单克隆抗体(例如,Cetuximab或Panitimumab)用于RAS野生型(WT)受试者III。BRAF抑制剂针对已知BRAF V600E突变的受试者•在最新批准的SOC化学治疗方案的最后剂量后3个月内或在3个月内进行的射线照相进展
使用基于DNA的验光工具对受体信号传导动力学的非核控制
生长因子(GFS)是多肽配体,这些配体调节各种细胞活性,例如增殖,迁移和分化。在细胞膜上GFS与受体酪氨酸激酶(RTK)的结合可诱导RTK的二聚化和随后的磷酸化,并启动细胞内激酶的磷酸化级联反应。1有趣的是,RTK下游激酶的激活动力学在确定细胞功能和命运方面起着重要作用(图1)。2例如,在大鼠PC12细胞中,表皮生长因子(EGF)和神经生长因子(NGF)都通过激活其同源受体激活RAS-RAF-MEKERK途径,但是激酶激活的动力学以及所得的细胞灭绝表现出独特的模式。3 EGF导致ERK的瞬时激活,导致细胞增殖,而NGF导致ERK的持续激活,从而导致细胞分化。迄今为止,已经关注了启动GF信号动力学的机制,从而调节细胞功能。因此,高度寻求能够控制具有精确时间分辨率的RTK活性的方法,以研究受体 -
RSC应用聚合物 芯片上的实验室-RSC Publishing 用气态二氧化碳捕获的生物质堆肥 绿色化学-RSC出版 多孔材料的逆设计:扩散模型方法 南极生态系统中的环境污染和气候变化:更新的概述 生物活性的趋势-RSC Publishing
Johnny Lam是FDA生物制品评估与研究中心的治疗产品办公室的生物医学工程师,在那里他既有铅产品审查和研究活动。Johnny的主要研究兴趣涉及研究基于复杂的细胞疗法以及其产品质量如何与功能相关的生物活性相关。他的研究着重于广泛的微生理系统的开发和适应,作为评估各种细胞类型的各种功能结果的平台,以提高制成细胞产品的质量和效力。Johnny获得了博士学位。在2015年的赖斯大学(Rice University)的生物工程中,他在那里开发并评估了可注射的多层水凝胶复合材料,用于细胞和受控生长因子递送,用于体内骨科组织修复。Johnny获得了博士学位。在2015年的赖斯大学(Rice University)的生物工程中,他在那里开发并评估了可注射的多层水凝胶复合材料,用于细胞和受控生长因子递送,用于体内骨科组织修复。
抗表皮生长因子受体治疗与抗血管内皮生长因子治疗对转移性结直肠癌的作用比较:随机临床试验的最新荟萃分析
摘要 针对表皮生长因子受体 (EGFR) 或血管内皮生长因子 (VEGF) 的单克隆抗体与化疗细胞毒药物联合用于转移性结直肠癌 (mCRC) 的一线治疗已显示出临床益处。比较这些单克隆抗体作为初始治疗的随机研究数据相互矛盾,而且它们的比较疗效仍然未知。本研究旨在通过结合随机临床试验的数据来评估抗表皮生长因子受体 (anti-EGFR) 治疗和抗血管内皮生长因子治疗联合对 mCRC 患者预后的影响。三项符合资格标准的试验和四项随机研究被纳入荟萃分析。对于 KRAS 野生型 (KRAS-WT) 的 MCRC 患者,接受抗 EGFR 治疗的患者的 ORR 优于接受抗 VEGF 治疗的患者。对于所有 RAS-WT 患者,这种效果甚至更好。 KRAS-WT mCRC 和所有 RAS-WT mCRC 两组的无进展生存期 (PFS) 率无显著差异。接受抗 EGFR 治疗的 RAS 野生型 (RAS-WT) mCRC 患者的总生存期 (OS) 较高,但 KRAS-WT 患者的总生存期 (OS) 高于抗 VEGF 治疗。我们的研究结果表明,在所有 RAS-WT MCRC 患者中,添加抗 EGFR 治疗与抗 VEGF 治疗相比,ORR 和 OS 均更优。对于 KRAS-WT mCRC,两组的 OS 和 PFS 没有显著差异。这些结果表明,与所有 RAS-WT mCRC 患者的抗 VEGF 治疗相比,抗 EGFR 单克隆抗体可以达到同等的疗效。
使用 Laponite 为骨组织工程提供 BMP-2
骨折不愈合是由多种因素引起的,从而导致可能出现严重的骨缺损。虽然自体移植和同种异体移植是目前治疗骨折不愈合的黄金标准,但与可用性和免疫排斥相关的挑战凸显了改进治疗方法的必要性。骨组织工程的一种策略是利用生长因子来诱导细胞改变其表型和行为,并启动信号通路,从而增加基质沉积和组织形成。骨形态发生蛋白-2 (BMP-2) 是一种有效的成骨生长因子,然而,鉴于其在体内的快速清除时间,存在特定的治疗窗口以发挥功效,同时避免潜在的有害副作用。结果表明,在 3D 可打印和生物可吸收的聚己内酯三甲基丙烯酸酯基树脂上涂覆 Laponite 纳米粘土能够结合 BMP-2,降低释放速率,从而能够降低使用浓度,同时在体外和体内模型中增强骨诱导作用。
阿帕替尼逆转晚期HER2阳性乳腺癌抗HER2耐药:两例报道及文献复习
肿瘤血管生成是恶性肿瘤发生、发展的重要机制之一,有助于肿瘤的生长和转移。血管内皮生长因子(VEGF)在血管生成中起着至关重要的作用,因此抗血管生成治疗已成为一种重要的抗肿瘤治疗方式(7)。阿帕替尼是一种高选择性的血管内皮生长因子受体2(VEGFR2)小分子TKI,可阻断下游信号通路的传递,明显抑制肿瘤的增殖(8)。目前阿帕替尼尚未获批用于乳腺癌,但其在晚期胃癌中具有良好的疗效和安全性(9)。目前,阿帕替尼逆转HER2耐药晚期乳腺癌的疗效报道较少,有报道称阿帕替尼单药治疗在HER2靶向治疗耐药的晚期HER2阳性乳腺癌中有良好的获益(10)。我们考虑阿帕替尼联合抗 HER2 疗法是否可以逆转 HER2 耐药性。
在分子选择的晚期非小细胞肺癌
血管生成在肿瘤发育,增殖和转移中起着基本作用(1,2)。血管生成固有的分子途径为非小细胞肺癌(NSCLC)的有效疗法提供了几个靶标(1)。这些靶标包括血管内皮生长因子(VEGF),血小板衍生的生长因子(PDGF),成纤维细胞生长因子(FGF)及其相应的受体(2)。VEGF是众所周知的血管生成的关键调节剂,主要通过VEGF受体2(VEGFR2)促进血管结构发展,调节血管通透性和诱导血管泄漏的信号(3)。酪氨酸激酶抑制剂(TKI)通过与三磷酸腺苷(ATP)竞争激酶结构域的活性位点,抑制该途径中的多个受体(4)。PDGF途径通过其对周细胞和血管平滑肌细胞的影响在血管结构的发展和稳定中起作用(5)。FGF受体(FGFR)激酶激活信号通路,导致内皮细胞激活,周细胞的募集和血管平滑