XiaoMi-AI文件搜索系统
World File Search System探索药物安全:社区药房的新 ISMP 最佳实践
a. 在生产过程中安装并使用条形码验证来扫描每个药品或疫苗包装或容器 b. 在输入药物订单时,在电子系统中使用口服甲氨蝶呤的每周给药方案默认值 c. 使用标准协议验证患者身份,仅使用一个患者标识符 d. 在开具、分配和测量口服液体药物时,使用毫升 (mL) 作为计量单位
EMA:CHMP会议亮点获批准...
每瓶 100 ml 注射液可用于治疗年龄在 2 岁及以上的活动性多关节型幼年特发性关节炎 (pJIA;类风湿因子阳性或阴性多关节炎和延长性少关节炎),这些患者之前接受过传统合成 DMARDs (csDMARDs) 治疗但效果不佳。 Sarilumab 可单独使用或与甲氨蝶呤联合使用。预充注射器中的150毫克和200毫克注射液的适应症保持不变(成人中度至重度活动性类风湿性关节炎)。
儿童急性淋巴细胞白血病 (ALL) 的进展和未来方向
• VHR 患者(年龄 >13 岁、细胞遗传学不良、反应缓慢) - 强化巩固/延迟强化 • 添加环磷酰胺/依托泊苷 +/- 氯法拉滨 • HR 患者 - 强化鞘内治疗 • 三联鞘内治疗 vs 鞘内甲氨蝶呤 • 结果 - VHR • 添加氯法拉滨 à 毒性太大 • 添加环磷酰胺/依托泊苷 à 无益处 - HR • 三联鞘内治疗 à 无益处
我患有自身免疫性风湿病*,我应该接受Covid-19的疫苗吗?
利妥昔单抗,已知可减少疫苗的免疫反应。其他药物,例如甲氨蝶呤或JAK抑制剂(Tofacitinib(Xeljanz),Bariticinib(Olumiant),Upadacitinib(Rinvoq))或泼尼松,以较高剂量(> 20 mg/Day)可能会在接受某些疫苗后降低保护,尽管大多数人仍可以降低保护,但仍可以保护某些疫苗。如果您决定采用疫苗,您的医疗保健提供者可以帮助您决定如何处理药物。对于许多患者,持续药物是避免疾病耀斑的最佳选择。
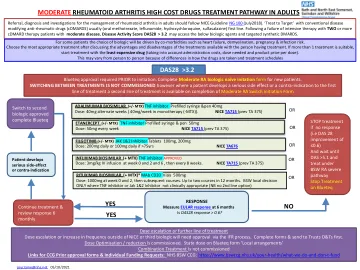
中度类风湿性关节炎高成本药物治疗...
成人类风湿性关节炎的转诊、诊断和检查应遵循 NICE 指南 NG 100(2018 年 7 月)。“靶向治疗”通常使用传统的抗风湿药物 (cDMARDS)(口服甲氨蝶呤、来氟米特、羟氯喹、柳氮磺吡啶)作为一线治疗。在两种或两种以上 cDMARD 疗法的强化治疗失败后,疾病活动性评分 DAS28 > 3.2 的中度疾病患者可以使用以下生物制剂和靶向合成 DMARDS。
炎症性疾病 - Olumiant 事先授权政策
强效局部皮质类固醇和/或全身皮质类固醇。类固醇减量疗法可减轻长期使用皮质类固醇带来的风险,包括环孢菌素、甲氨蝶呤和硫唑嘌呤。• COVID-19:美国传染病学会 (IDSA) 和美国国立卫生研究院 (NIH) 制定了 COVID-19 治疗指南;两项指南均涉及 Olumiant 的使用。3,4 IDSA 和 NIH 指南均建议住院的 COVID-19 患者使用 Olumiant 持续 14 天或直至出院。• 类风湿性关节炎:美国风湿病学会 (2021) 指南建议对于服用最大耐受剂量甲氨蝶呤但未达到目标剂量的患者,添加生物制剂或靶向合成的改善病情的抗风湿药 (DMARD)。 2 政策声明 建议对 Olumiant 的处方福利覆盖进行事先授权。所有批准的有效期如下。如果批准以月为单位,则 1 个月等于 30 天。由于评估和诊断接受 Olumiant 治疗的患者需要专业技能,并且需要监测不良事件和长期疗效,某些适应症的初步批准需要由专门治疗所治疗病症的医生开具 Olumiant 处方或与其会诊。所有关于在住院 COVID-19 患者中使用 Olumiant 的请求都将转发给医学主任。值得注意的是,这包括与 COVID-19 相关的细胞因子释放综合征的请求。
智慧之战:炎症性 RMD 中的免疫抑制与免疫调节
过去二十年见证了免疫介导炎症疾病靶向治疗的革命,主要是针对风湿病。这些疗法包括肿瘤坏死因子 (TNF) 阻断、白细胞介素 (IL)-6 受体阻断、IL-1 阻断、IL-17 阻断、IL-12/23 阻断、B 细胞耗竭和共刺激阻断。其他靶点,如 I 型干扰素和粒细胞巨噬细胞集落刺激因子 (GM-CSF) 仍在研究中。1 最近,Janus 激酶 (JAK) 抑制为靶向干预提供了一条小分子途径。这些疗法具有革命性,主要是因为它们提供了前所未有的疗效和相对安全性。因此,TNF 抑制剂发生严重感染的风险略高于传统的合成抗病药物(如甲氨蝶呤),但明显低于大剂量的糖皮质激素等。2 3 同样,多项研究也未能证明生物和靶向合成的抗风湿药物(DMARDs)会增加罹患实体癌或淋巴瘤的风险。4 值得注意的是,甲氨蝶呤治疗仍然是类风湿性关节炎(RA)治疗的基石,但它并没有显著的免疫抑制作用,因为在对非 RA 患者进行的心血管炎症减少试验(CIRT)中,尽管所研究的人群中存在严重的合并症,但感染的风险率很低(1.15(CI:1.01 至 1.30))。 5 6 这些数据与用于移植等适应症的免疫抑制药物形成了鲜明对比——这些药物在当时也是革命性的。肾移植术后 1 年生存率为
申请事先授权 JANUS 激酶 (JAK) 抑制剂
Janus 激酶 (JAK) 抑制剂需要事先授权。当满足以下条件时,将考虑为 FDA 批准或概要指示的诊断付款:1. 患者符合 FDA 批准的年龄;2. 患者未使用或计划将 JAK 抑制剂与其他 JAK 抑制剂、生物 DMARD 或强效免疫抑制剂(硫唑嘌呤或环孢菌素)联合使用;3. 在开始治疗前已接受潜伏性结核病检测,并将在治疗期间监测活动性结核病;4. 正在根据制造商标签对淋巴细胞、中性粒细胞、血红蛋白、肝酶和脂质进行建议的实验室监测;5. 患者没有恶性肿瘤病史,非黑色素瘤皮肤癌 (NMSC) 成功治疗的患者除外;6. 患者的胃肠道穿孔风险没有增加。7. 患者没有活动性严重感染,包括局部感染;和 8. 不会与活疫苗同时给药;和 9. 遵循 FDA 批准的适应症剂量;和 10. 患者有以下诊断:a. 中度至重度类风湿性关节炎,i. 有记录的试验记录并且对同时使用的两种首选口服抗风湿药物 (DMARD) 反应不足。组合必须包括甲氨蝶呤加另一种首选口服 DMARD(羟氯喹、柳氮磺吡啶或来氟米特);和 ii. 有记录的试验记录并且对两种首选生物 DMARD 反应不足;或 b. 银屑病关节炎,i. 有记录的试验记录并且对首选口服 DMARD 甲氨蝶呤(如果甲氨蝶呤禁忌,可以使用来氟米特或柳氮磺吡啶)治疗反应不足;和 ii. 有记录的试验记录并且使用两种用于治疗银屑病关节炎的首选生物制剂的治疗失败。c.中度至重度活动性溃疡性结肠炎,且 i. 已记录的试验结果和对两种首选常规疗法(包括氨基水杨酸盐和硫唑嘌呤/6-巯基嘌呤)的反应不足;和 ii. 已记录的试验结果和对首选生物 DMARD 的反应不足;和 iii. 如果托法替尼的请求剂量为每天两次 10 毫克,则将允许进行初始 16 周的治疗。继续请求,因为此剂量需要记录足够的治疗效果。
托法替尼(XELJANZ)在强直性脊柱炎国家...
• 患者患有活动性强直性脊柱炎,根据巴斯强直性脊柱炎疾病活动指数 (BASDAI) 和 BASDAI 背痛评分均为 ≥ 4(尽管服用了 ≥ 2 种 NSAID)或对 NSAID 不耐受。已接受口服糖皮质激素或抗风湿药物 (DMARD) 治疗的患者,如果剂量稳定,可以参加试验。• 在 270 名随机患者中,91% 为男性,79% 为白人,约 10% 来自北美,39% 来自欧盟,23% 来自亚洲,31% 来自其他国家。患者平均年龄约为 41 岁。• 几乎所有患者 (99.7%) 都曾使用过 NSAID,77% 未使用过生物 DMARD,1.1% 曾使用过生物 DMARD 但反应不佳。 62 名患者(23%)对不超过两种 TNFI 反应不足或曾使用过生物 DMARD 治疗(包括 TNFI)但反应不足,其中分别有 43 名患者(16%)和 16 名患者(6%)对一种和两种 TNFI 反应不足。• 排除当前或既往使用针对性合成 DMARD(包括 JAKI)治疗和当前生物 DMARD 治疗的患者。• 稳定剂量的 NSAID、甲氨蝶呤(≤ 25 mg/周)、柳氮磺吡啶(≤ 3 g/天)和口服糖皮质激素(≤ 10 mg/天泼尼松当量)可继续作为背景疗法。在第 1 天,约 80% 的患者使用 NSAID,8% 使用口服糖皮质激素,27% 的患者同时使用常规合成免疫调节剂(甲氨蝶呤或柳氮磺吡啶)。
阴性类风湿关节炎pate
在莱顿早期关节炎诊所队列中,在1993年至2016年之间连续1,285例RA患者,并每年遵循。随着时间的推移,常规护理中的治疗方案有所改善,无论自身抗体状态如何,5个纳入期被用作仪器变量:1993 - 1996年,延迟了轻度疾病的抗病药物(DMARD)起始(参考期); 1997 - 2000年,早期的轻度dmard; 2001 - 2005年,早期甲氨蝶呤; 2006 - 2010年,早期甲氨蝶呤,然后进行靶向靶向调整; 2011–2016,类似于2006- 2010年,加上额外的早期推荐努力。研究了三个长期结果:持续的无DMARD缓解(SDFR)(DMARD停止后持续缺乏临床滑膜炎),死亡率和通过年度健康评估问卷(HAQ)衡量的功能残疾。在短期(疾病活性)中通过疾病活动评分– 28测量红细胞沉降率(DAS28-ESR)。线性混合模型和COX回归,分为自身抗体阳性,定义为IgG抗CCP2和/或IgM类风湿因子阳性。总共有823例自身抗体阳性RA(平均年龄55岁,女性为67%); 462例患者患有自身抗体阴性RA(60岁,女性64%)。在整个纳入期间,自身抗体阳性患者的年龄,一代和百分比是稳定的。疾病活性在两组中随时间的均显着降低。SDFR费率