XiaoMi-AI文件搜索系统
World File Search System用于生成trichoderma koningiopsis的原生质体和质粒DNA
转换方案可以在一天之内进行PEG介导的转换和ATMT,而对于电穿孔和LiPofection,这两者都可以在半天内完成。但是,材料和设备设置部分中列出的缓冲区和材料的早期准备是必不可少的。要准备培养物,必须根据所选技术在3到5天之间生长真菌。菌丝体可以在3天后在液体培养中产生,但是对于孢子,必须在固体培养基上生长4-5天。转化后,必须将真菌种植2周,在此期间需要3个亚文化才能获得均应转化剂。全部,转换的时间表在3到4周之间。使用质粒PDHT/SK-CEP进行所有实验,为此,骨架是从Zhihua Zhou(addgene质粒#92126)获得的。7
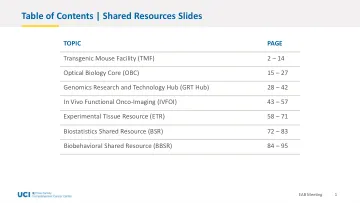
目录 | 共享资源幻灯片
• 由于缺乏有效的体内模型,与人类遗传病相关的非编码变异的功能表征仍然具有挑战性。 • Dual-enSERT-2 是一种强大的基于 CRISPR 的双色荧光报告系统,可快速定量分析活体 G0 第一代转基因小鼠中的增强子等位基因活性。 • Dual-enSERT 可与单细胞转录组学相结合,以细胞分辨率表征变异增强子等位基因活性,揭示与致病增强子失调有关的候选分子通路(例如介导神经胶质瘤形成的 IDH1 增强子变异)。 • TMF 对小鼠受精卵和胚胎进行显微注射和电穿孔,并将其转移到假孕受体小鼠中供 Kvon 实验室使用。
CRISPR/Cas9 核糖核蛋白 (RNP) 复合物在急性髓系细胞基因组编辑中提高转染细胞的活力
成簇的规律间隔短回文重复序列 (CRISPR)/CRISPR 相关蛋白 9 (Cas9) 系统已成为修改多种细胞类型基因表达的重要工具,在肿瘤治疗中显示出前所未有的潜力 (2)。许多研究已将 CRISPR/Cas9 应用于治疗相关的体外和体内实验 (3)。然而,由于 Cas9 蛋白的尺寸较大 (160 kDa),CRISPR/Cas9 的应用受到限制。迫切需要高效、安全地将 CRISPR/Cas9 递送到 AML 细胞中以探索新的治疗靶点。近年来,CRISPR/Cas9 核糖核蛋白 (RNP) 复合物已通过电穿孔直接递送到肿瘤细胞中,由于 RNP 复合物的寿命短,脱靶效应减少 (4-9)。
简介 Hb G-Makassar β-珠蛋白的检测...
我们的 Hb G-Makassar 直接编辑策略证明了电穿孔后 CD34 + 细胞单个碱基的高编辑效率,这种效率在杂合和纯合镰状细胞的红细胞分化过程中得以维持。此外,我们还能够通过一种新型 UPLC 方法和 LC-MS 解析并确认 Hb G-Makassar b 珠蛋白变体的安装。我们证明,在高编辑效率下,可以实现高双等位基因编辑,将 HbS 珠蛋白水平降低至 <15%,并减少暴露于缺氧条件下的编辑细胞的体外镰状化。结合自体干细胞移植,将致病镰状细胞突变直接编辑为自然发生且无症状的 Hb G-Makassar 是一种有前途的镰状细胞患者新治疗模式。
关于小鼠CRISPR基因组编辑的研讨会,重点是性腺和显微注射,2023年12月13日至15日。
这个研讨会的一个主要目标是为每个学生提供新浸渍的动物,每天下午执行性腺手术,直到他们取得成功。EGFP mRNA用于性腺电穿孔,并获得了荧光胚胎的成功。到此,每天早晨,在性腺手术后,从与特定学生外科医生相关的单个小鼠中分离出卵,并分析荧光。由研讨会结论,所有学生都成功地产生了发光的胚胎。此外,由于大量的女性,外部讲师(Gurumurthy博士和Williams博士)以及供应商(来自BEX Inc.)能够成功执行该技术。显微注射,在整个课程中,两个带有Zygotes的微注射系统可供学生在教师监督下利用作为此技术的介绍。
Immuno Cure Biotech 公布治疗性 HIV DNA 疫苗 I 期临床试验的良好结果 免疫疗法的令人鼓舞的发现
本次I期临床试验是一项随机、双盲、安慰剂对照、剂量递增研究,经国家药品监督管理局(“NMPA”)批准,在深圳市第三人民医院(“深圳市第三医院”)开展,旨在评估ICVAX在临床稳定的HIV-1感染者(这些患者的病毒复制通过抗逆转录病毒疗法得到很好的抑制)中的安全性、最大耐受剂量和探索免疫原性(clinicaltrials.gov编号NCT06253533),(“I期试验”)。共招募了45名参与者,并随机分配到三个剂量组(1毫克、2毫克和4毫克组),每组的ICVAX与安慰剂的比例为12:3。使用Immuno Cure经NMPA批准的II类Teresa EP设备(“Teresa EP”)通过电穿孔递送ICVAX。
基因敲除试剂盒
我们强烈建议您在使用靶向特异性多向导 sgRNA 之前,先使用特定细胞类型的阳性对照优化转染条件。为了优化人类细胞系的条件,EditCo 提供了转染优化试剂盒,其中包含靶向人类 TRAC 的阳性对照多向导 sgRNA。对于小鼠细胞系,我们建议使用靶向小鼠 Rosa26 的阳性对照单向导 sgRNA 来优化您的条件(请参阅第 2 页所需的其他材料)。我们建议为您的基因组编辑实验形成核糖核蛋白 (RNP) 复合物,以最大限度地提高编辑效率并减少脱靶效应。选择 EditCo 的电穿孔、脂质转染或核转染方案与此试剂盒一起使用。所有方案均可在 editco.com/resources 上找到。
通过 CRISPR 基因组编辑探究人类小胶质细胞的吞噬作用
背景:小胶质细胞是中枢神经系统不可或缺的一部分,但由于获取和培养原代人类小胶质细胞的挑战,我们对小胶质细胞生物学的了解有限。HMC3 是研究人类小胶质细胞的重要细胞系,因为它易于获取且易于在标准实验室中维护。尽管 HMC3 广泛用于小胶质细胞研究,但尚未描述强大的遗传方法。在这里,我们报告了一个 CRISPR 基因组编辑平台,通过电穿孔 Cas9 核糖核蛋白 (Cas9 RNP) 和合成 DNA 修复模板,实现 HMC3 的快速和精确的基因修饰。为了进行概念验证演示,我们针对了与调节小胶质细胞中的淀粉样蛋白 β (A b ) 和胶质母细胞瘤吞噬作用有关的基因。我们表明,CRISPR 基因组编辑可以增强 HMC3 的吞噬活性。
BMS652:动植物生物技术
2。2.0植物的技术和遗传操纵2.1)将DNA引入植物 - 间接方法(粒子轰炸,聚乙烯乙二醇,(PEG)电穿孔,碳化硅纤维纤维等)的方法和直接方法(硅核酸杆菌纤维纤维等)(Agrobacterium介导的基因Tranfer)2.2)植物变换 - 基本特征Vectoration-vectortation sos sos vectoration sos vectoration sos vectoration。2.3) - 遗传操纵在农业中的应用 - 使用有关除草剂耐药性,耐药性,抗病性,降低病毒疾病的影响,胁迫耐受性,提高作物产量和质量的案例研究,分子药物。2.4)生物伦理学 - 对转基因作物(抗生素耐药性基因,除草剂耐药性和“超级weed”基因污染物,大企业)和GM作物和产品法规的关注。
理学学士植物学 V 和 VI 学期课程大纲,符合 NEP 2020。
酶学与酶技术:酶的定义、酶学与酶技术、酶的性质、酶的应用、酶的生产技术、酶的固定化。第 4 单元:重组 DNA 技术:重组 DNA 的概念、重组 DNA 技术的生物工具、基因的修饰、基因转移的方法、转基因生物。第 5 单元:DNA 结构与操作 - DNA 分离与纯化技术。DNA 样本的定量与表征方法。RNA 分析与基因表达 - RNA 分离与纯化方法。基因表达分析。第 6 单元:基因操作技术 - 基因传递方法。物理、化学和生物方法。转化、转染、电穿孔和微注射。细菌和真核生物中的基因敲除技术。第 7 单元:基因组编辑 - 基因组编辑技术简介 - 基因组编辑技术的原理和应用。CRISPR-Cas9、定点诱变和其他基因组编辑方法。