XiaoMi-AI文件搜索系统
World File Search System双特异性抗体 (BsAb) 细胞因子释放综合征 (...
定义 双特异性抗体 (BsAb):一个抗体分子中包含 2 个不同的靶向特异性单元。在肿瘤学中,这些 BsAb 通常将恶性细胞与免疫细胞连接起来,阻止细胞生长并激活免疫系统(T 细胞)。 双特异性 T 细胞接合剂 (BiTE):一种与恶性细胞上的肿瘤相关抗原和 T 细胞上的表面分子接合的 BsAb 细胞因子:由大多数细胞产生和分泌的蛋白质,作为信使促进多种功能,包括炎症反应。细胞因子的例子包括白细胞介素、干扰素和肿瘤坏死因子。 细胞因子释放综合征 (CRS):由 BsAb 等 T 细胞接合疗法的作用引发的过度全身炎症反应,导致炎症细胞因子的释放。CRS 症状范围从轻微的流感样症状到严重的多器官衰竭。免疫效应细胞相关神经毒性综合征 (ICANS):BsAb 治疗后释放的细胞因子的炎症作用引起的神经毒性,导致血脑屏障破坏和中枢神经系统中炎症细胞因子的积累。ICANS 是在排除其他可能性后做出的排除性诊断。 BsAbs 和适应症 Blinatumomab (BLINCYTO):复发或难治性 CD19 阳性 B 细胞前体急性淋巴细胞白血病 (ALL) Elranatamab (ELREXFIO):复发或难治性多发性骨髓瘤 (BCMA 靶点) [REMS 计划] Epcoritamab (EPKINLY):复发或难治性大 B 细胞淋巴瘤 (CD20 靶点) Glofitamab (COLUMVI):复发或难治性大 B 细胞淋巴瘤 (CD20 靶点) Mosunetuzumab (LONSUMIO):复发或难治性滤泡性淋巴瘤 (CD20 靶点) Talquetamab (TALVEY):复发或难治性多发性骨髓瘤 (GPRC5D 靶点) [REMS 计划] Tebentafusp (KIMMTRAK):HLA-A*02:01 不可切除或转移性葡萄膜黑色素瘤Teclistamab (TECVAYLI):复发或难治性多发性骨髓瘤(BCMA 靶点)[REMS 计划]
肠道综合征中的肠道微生物组和细胞因子谱
1以微生物和病毒学系以阿斯塔纳医科大学的Sh.i.Sarbasova命名,阿斯塔纳010000,哈萨克斯坦; dusmagambetov.m@amu.kz(M.D. ); dusmagambetova.a@amu.kz(A.D。)2 Microbiome实验室,生命科学中心,国家实验室阿斯塔纳实验室,纳扎尔巴耶夫大学,阿斯塔纳010000,哈萨克斯坦; skozhakhmetov@nu.edu.kz(S.K. ); madiyar.nurgaziyev@nu.edu.kz(M.N。 ); zharkyn.jarmukhanov@nu.edu.kz(Z.J. ); st.paulmississippi@gmail.com(e.v. ); laura.chulenbayeva@nu.edu.kz(L.C。) 3阿斯塔纳医科大学,阿斯塔纳010000,哈萨克斯坦阿斯塔纳医科大学的小儿传染病系; mynzhanova.a@amu.kz(A.M。); Daulbaeva.a@amu.kz(A.D。)4国家研究心脏外科中心,阿斯塔纳010000,哈萨克斯坦; tauekelovajnura@gmail.com(A.T。); cardiacsurgeryres@gmail.com(m.b。) *信函:mussabay.k@amu.kz(K.M. ); akushugulova@nu.edu.kz(又称)1以微生物和病毒学系以阿斯塔纳医科大学的Sh.i.Sarbasova命名,阿斯塔纳010000,哈萨克斯坦; dusmagambetov.m@amu.kz(M.D.); dusmagambetova.a@amu.kz(A.D。)2 Microbiome实验室,生命科学中心,国家实验室阿斯塔纳实验室,纳扎尔巴耶夫大学,阿斯塔纳010000,哈萨克斯坦; skozhakhmetov@nu.edu.kz(S.K.); madiyar.nurgaziyev@nu.edu.kz(M.N。); zharkyn.jarmukhanov@nu.edu.kz(Z.J.); st.paulmississippi@gmail.com(e.v.); laura.chulenbayeva@nu.edu.kz(L.C。)3阿斯塔纳医科大学,阿斯塔纳010000,哈萨克斯坦阿斯塔纳医科大学的小儿传染病系; mynzhanova.a@amu.kz(A.M。); Daulbaeva.a@amu.kz(A.D。)4国家研究心脏外科中心,阿斯塔纳010000,哈萨克斯坦; tauekelovajnura@gmail.com(A.T。); cardiacsurgeryres@gmail.com(m.b。)*信函:mussabay.k@amu.kz(K.M.); akushugulova@nu.edu.kz(又称)
干扰素是作用于1型糖尿病胰岛上的关键细胞因子
摘要目标/假设促炎细胞因子IFN-α,IFN-γ,IL-1β和TNF-α可能有助于1型糖尿病胰岛炎期间的先天和适应性免疫反应,因此代表有吸引力的治疗靶标可保护β细胞。然而,这些细胞因子中每一种在胰腺β细胞上的具体作用仍然未知。方法我们使用了深度RNA-Seq分析,然后进行了基于逆转录定量PCR(RT-QPCR),蛋白质印迹,组织学和siRNAS的广泛确认实验,以表征人类胰腺β细胞对每个细胞因子对单独的细胞因子的反应,并比较了与iSSET中所产生的签名相比。与IL-1β和TNF-α相比,IFN-α和IFN-γ对β细胞转录组的影响更大。IFN诱导的基因特征与1型糖尿病个体的β细胞中观察到的基因具有很强的相关性,并且特定IFN刺激的基因的表达水平与存在于这些个体的胰岛中的蛋白质正相关,从而调节了β细胞对“危险信号”等病毒感染的反应。锌指NFX1型含有1(Znfx1),一种双链RNA传感器,被IFN高度诱导,并证明在β细胞的抗病毒反应中起关键作用。结论/解释这些数据表明,IFN-α和IFN-γ是人类1型糖尿病的胰岛水平的关键细胞因子,有助于自身免疫性的触发和扩增。
博士学位 - 细胞因子诱导的杀伤(CIK)细胞免疫疗法
https://findanexpert.unimelb.edu.au/opportunity/1441-delineating-the-role-of-surface- pd-l1-on-extracellular-vesicles-in-response-to-cytokine-induce-d-killer-(cik)-cells- immunotherapy-in-glioblastoma
警报细胞因子在寄生虫感染中发挥的关键且多样的作用
包括 IL-25、IL-33 和胸腺基质淋巴细胞生成素 (TSLP) 在内的警报素细胞因子可作为危险信号触发宿主免疫,以应对寄生虫感染等致病因素引起的组织损伤。寄生虫病也为研究其功能和机制提供了极好的背景。许多研究表明,非免疫细胞(如上皮细胞和基质细胞)释放的警报素细胞因子会诱导宿主启动 2 型免疫,从而驱除寄生虫,但也会导致宿主病理,如组织损伤和纤维化。相比之下,来自免疫细胞(如树突状细胞)的警报素细胞因子(尤其是 IL-33)可能会引发免疫抑制环境,从而促进宿主对寄生虫的耐受性。此外,据报道,警报素细胞因子在寄生虫感染中的作用取决于寄生虫种类、警报素细胞因子的细胞来源和免疫微环境,所有这些都与寄生部位或器官有关。本叙述性综述旨在提供有关警报素细胞因子在涉及不同器官(包括肠、肺、肝和脑)的寄生虫感染中的关键和多样化作用的信息。
cOVID-19诱导CNS细胞因子表达和海马神经发生的丧失
严重急性呼吸道综合征2(SARS-COV-2)感染与急性和急性认知和神经精神症状有关,包括记忆力受损,浓度,注意力,睡眠和AFECT。这些大脑症状背后的机制仍在研究。在这里,我们报告说,尽管血液异常 - 脑屏障的通透性异常,但SARS-COV-2感染的仓鼠表现出缺乏病毒神经侵袭。Hamsters and patients deceased from coronavirus disease 2019 (COVID-19) also exhibit microglial activation and expression of interleukin (IL)-1 β and IL-6, especially within the hippocampus and the medulla oblongata, when compared with non-COVID control hamsters and humans who died from other infections, cardiovascular disease, uraemia or trauma.在Covid-19仓鼠和人类的海马齿状回中,我们观察到更少的神经爆炸和未成熟的神经元。持续的炎症,血液 - 脑屏障破坏和小胶质细胞激活可能会导致神经传递,神经发生和神经元损害改变,从而解释了Covid-19的神经精神上的表现。海马的参与可能解释了COVID-19患者的学习,记忆和执行功能障碍。
免疫细胞因子和 PD-1 阻断的免疫疗法可增强抗癌效果
本预印本的版权所有者(此版本于 2020 年 6 月 6 日发布。;https://doi.org/10.1101/2020.06.03.129049 doi: bioRxiv preprint
牙龈炎和牙周炎中的细胞因子:从发病机理到治疗靶标
口腔粘膜和牙周炎中的慢性炎症过程是由微虫和微生物生物膜引起的常见疾病。这些因素激活了先天性和适应性免疫系统,从而导致了促炎性细胞因子的产生。已知细胞因子在牙龈炎和牙周炎的发病机理中起着至关重要的作用,并已被提议作为诊断和随访这些疾病的生物标志物。它们可以激活免疫细胞和基质细胞,从而导致局部炎症和组织损伤。这种损害可能包括破坏牙周韧带,牙龈和牙槽骨。研究报告了牙周炎患者的局部促炎细胞因子的局部水平增加,例如白介素1Beta(IL-1Beta),肿瘤坏死因子(TNF),IL-6,IL-17和IL-23。在牙周炎的实验模型中,TNF和IL-23/IL-17轴在疾病发病机理中起关键作用。通过中和抗体,基因工程或IL-10功能的中和途径灭活以减少疾病活性。 本综述讨论了细胞因子在牙龈炎和牙周炎中的作用,特别是它们在介导炎症和组织破坏中的作用。 它还探索了新的治疗性干预措施,这些干预措施为这些慢性炎性疾病的研究和临床治疗提供了潜力。通过中和抗体,基因工程或IL-10功能的中和途径灭活以减少疾病活性。本综述讨论了细胞因子在牙龈炎和牙周炎中的作用,特别是它们在介导炎症和组织破坏中的作用。它还探索了新的治疗性干预措施,这些干预措施为这些慢性炎性疾病的研究和临床治疗提供了潜力。
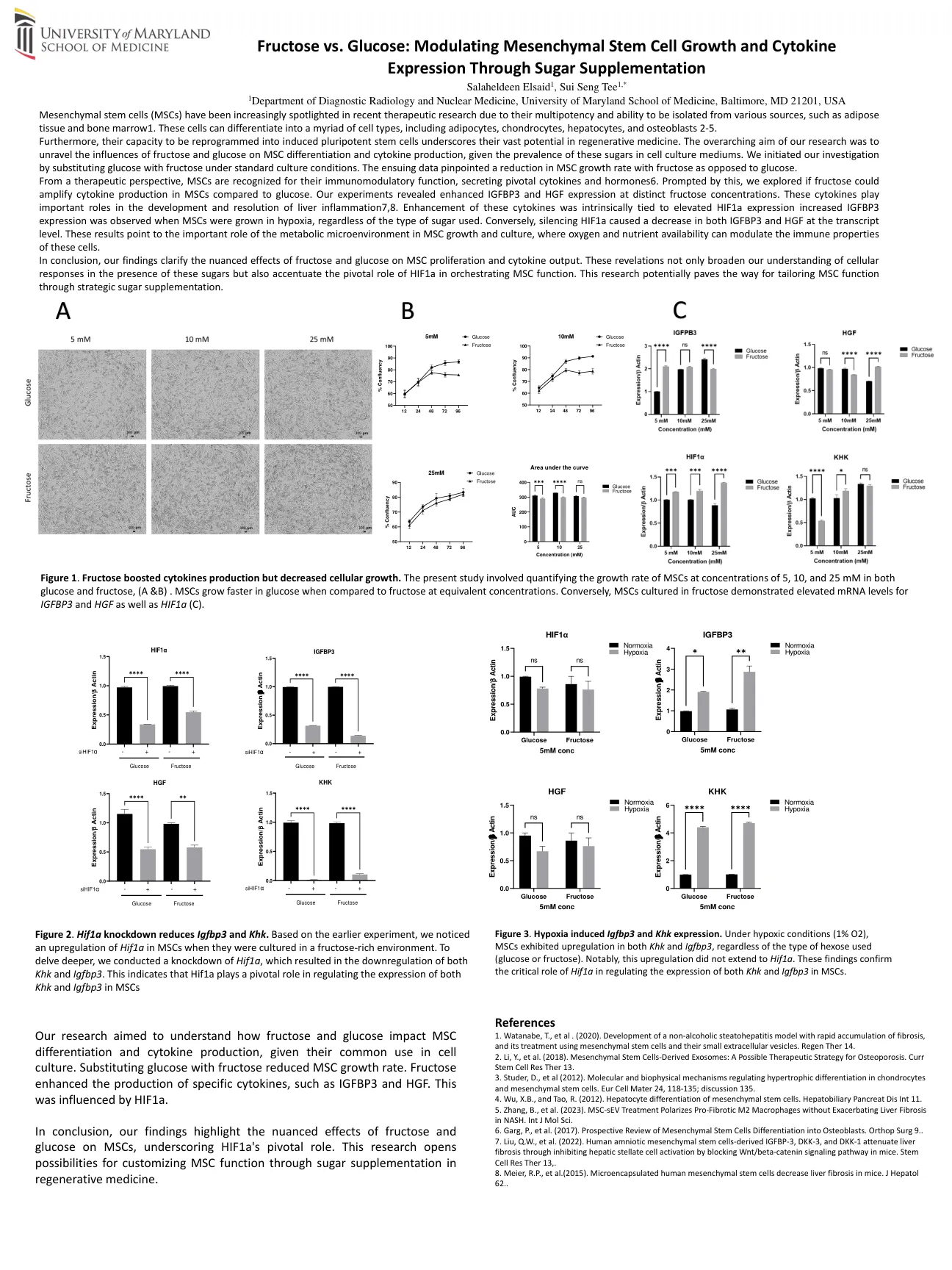
果糖与葡萄糖:调节间充质干细胞生长和细胞因子
1马里兰大学医学院诊断放射学和核医学系,巴尔的摩,马里兰州,马里兰州21201,美国,美国间质干细胞(MSC),在最近的治疗研究中,由于其多能力和与各种来源隔离的能力,例如脂肪组织和骨Marrow1。这些细胞可以分化为无数细胞类型,包括脂肪细胞,软骨细胞,肝细胞和成骨细胞2-5。此外,将其重新编程为诱导多能干细胞的能力强调了其在再生医学中的巨大潜力。我们的研究的总体目的是揭示果糖和葡萄糖对MSC分化和细胞因子产生的影响,鉴于这些糖在细胞培养基中的流行率。我们通过在标准培养条件下用果糖代替葡萄糖来开始研究。随后的数据指出了果糖而不是葡萄糖的MSC生长速率降低。从治疗的角度来看,MSC因其免疫调节功能而被认可,分泌关键的细胞因子和激素6。在此提示的情况下,我们探讨了与葡萄糖相比,果糖是否可以扩增MSC中的细胞因子产生。我们的实验表明,在不同的果糖浓度下,IGFBP3和HGF表达增强。这些细胞因子在肝脏炎症的发育和解决中起着重要作用7,8。这些细胞因子的增强本质上与HIF1A表达升高相关,而当MSC在缺氧中生长时,就会观察到IGFBP3表达,无论使用的糖类型如何。相反,沉默的HIF1A在转录级别导致IGFBP3和HGF的降低。这些结果表明,代谢微环境在MSC生长和培养中的重要作用,其中氧气和养分的可用性可以调节这些细胞的免疫特性。总而言之,我们的发现阐明了果糖和葡萄糖对MSC增殖和细胞因子输出的细微影响。这些启示不仅扩大了我们在存在这些糖的情况下对细胞反应的理解,而且还强调了HIF1A在策划MSC功能中的关键作用。这项研究可能为通过补充战略糖来量身定制MSC功能铺平了道路。
苏丹患者的细胞因子特征在卡萨拉州,苏丹东部
姜黄素调节炎症酶的表达,例如环氧合酶-2(Cox-2)和诱导的一氧化氮合酶(INOS),这两种酶在各种炎症过程中都起着作用(50,51)。姜黄素抑制的另一种促炎性酶是5-脂氧酶(5-lox);姜黄素通过结合其活性位点抑制5-Lox活性(52)。姜黄素降低了与炎症介质结合的几个细胞表面分子的表达(12、19、25、41)。它还降低了C反应蛋白(CRP)和各种炎症细胞因子的表达,包括肿瘤坏死因子-Alpha(TNF-α),白介素8(IL-8),白介素6(IL-6)(IL-6)(IL-6)和趋化因子(53,54)。姜黄素抑制TNF-α的活性,TNF-α是最重要的促炎性介体之一(55)。此外,姜黄素抑制T淋巴细胞的增殖和迁移(56)。