XiaoMi-AI文件搜索系统
World File Search System顺式作用,亲和力调节IL-21免疫细胞免疫疗法的免疫细胞因子
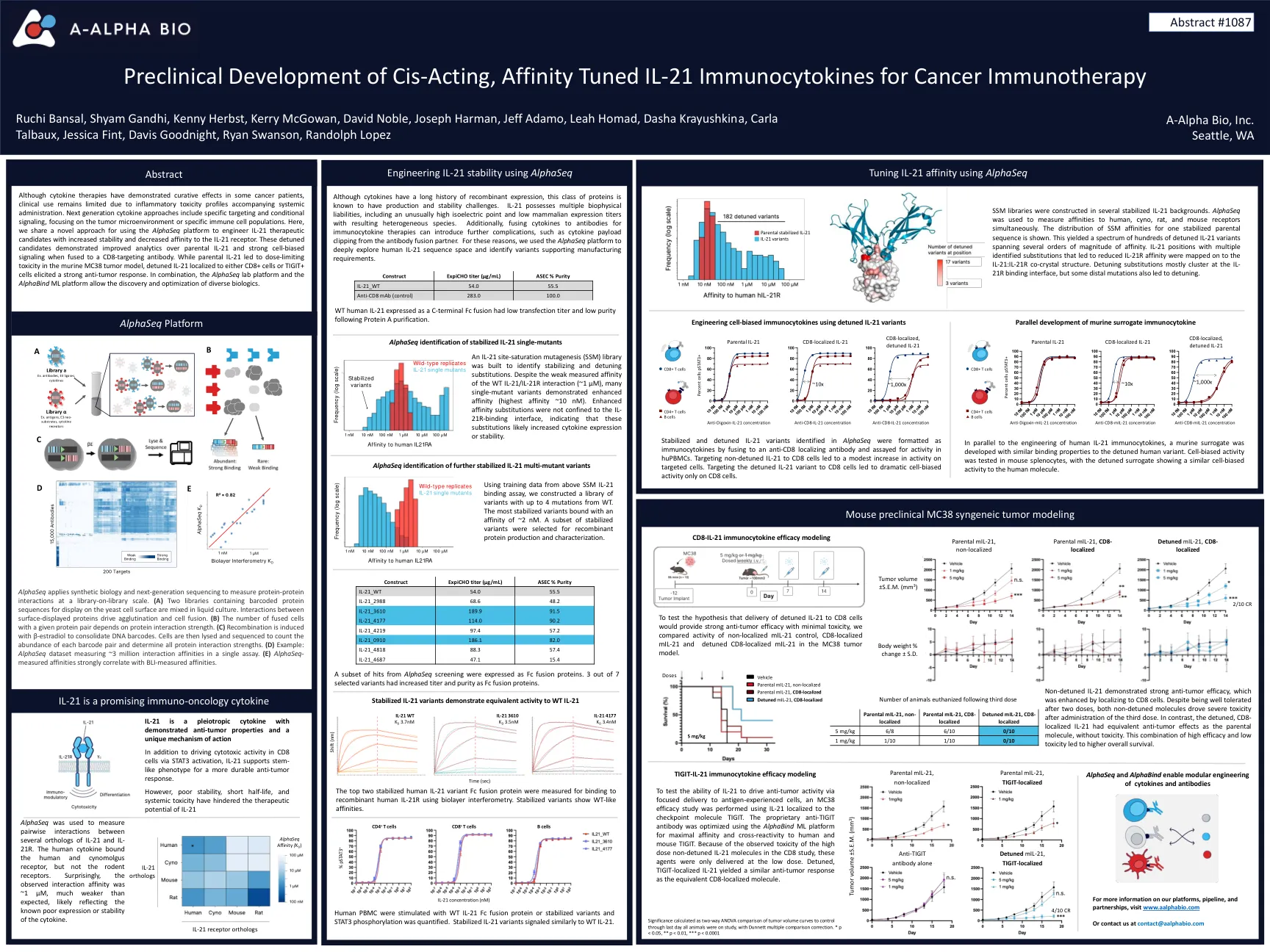
尽管细胞因子疗法在某些癌症患者中表现出治愈作用,但由于伴随全身给药的炎症毒性特征,临床用途仍然有限。下一代细胞因子方法包括特定的靶向和条件信号传导,重点是肿瘤微环境或特定的免疫细胞群体。在这里,我们共享一种新的方法,用于使用Alphaseq平台来设计IL-21治疗候选者,具有提高稳定性并降低对IL-21受体的亲和力。当与CD8靶向抗体融合时,这些失调的候选者对亲本IL-21和强细胞偏置信号传导的分析有所改善。虽然父母IL-21导致鼠MC38肿瘤模型中的剂量限制性毒性,但局部局部在CD8+细胞或Tigit+细胞的IL-21引起了强烈的抗肿瘤反应。结合使用,Alphaseq Lab Platform和Alphabind ML平台允许发现和优化各种生物制剂。
脾边缘区B细胞通过塑造细胞因子模式和细胞介导的免疫
Chen-Yu Tsai,1 Myo OO,1 Jih Hou Peh,2 Benjamin C.M.Yeo,3 Ariel Aptekmann,1 Bernett Lee,4,5,6 Joe J.J. Liu, 2 Wen-Shan Tsao, 1 Thomas Dick, 1,7 Katja Fink, 4 and Martin Gengenbacher 1,7,8, * 1 Center for Discovery and Innovation (CDI), Hackensack Meridian Health, 111 Ideation Way, Nutley, NJ 07110, USA 2 Biosafety Level 3 Core, Yong Loo Lin School of Medicine, National University of Singapore (NUS), Level 15, Centre for Translational Medicine (MD6), NUS, 14 Medical Drive, Singapore 117599, Singapore 3 Infectious Diseases Translational Research Programme and Department of Medicine, Yong Loo Lin School of Medicine, National University of Singapore (NUS), Level 2, Blk MD4, 5 Science Drive 2, Singapore 117545, Singapore 4 Singapore Immunology Network (SIgN), Agency for Science Technology and Research, Biopolis, 8A Biomedical Grove, Level 3 & 4, Immunos Building, Singapore 138648, Singapore 5 Centre for Biomedical Informatics, Lee Kong Chian School of Medicine, Nanyang Technological University, 50 Nanyang Avenue, Singapore 639798, Singapore 6 A*STAR Infectious Diseases Labs, Agency for Science, Technology and Research, 8A Biomedical Grove #05-13, Immunos,新加坡138648,新加坡7 Hackensack Meridian医学院,Nutley,NJ 07110,美国8铅联系 *通信 *通信:martin.gengenbacher@gmail@gmail.comYeo,3 Ariel Aptekmann,1 Bernett Lee,4,5,6 Joe J.J. Liu, 2 Wen-Shan Tsao, 1 Thomas Dick, 1,7 Katja Fink, 4 and Martin Gengenbacher 1,7,8, * 1 Center for Discovery and Innovation (CDI), Hackensack Meridian Health, 111 Ideation Way, Nutley, NJ 07110, USA 2 Biosafety Level 3 Core, Yong Loo Lin School of Medicine, National University of Singapore (NUS), Level 15, Centre for Translational Medicine (MD6), NUS, 14 Medical Drive, Singapore 117599, Singapore 3 Infectious Diseases Translational Research Programme and Department of Medicine, Yong Loo Lin School of Medicine, National University of Singapore (NUS), Level 2, Blk MD4, 5 Science Drive 2, Singapore 117545, Singapore 4 Singapore Immunology Network (SIgN), Agency for Science Technology and Research, Biopolis, 8A Biomedical Grove, Level 3 & 4, Immunos Building, Singapore 138648, Singapore 5 Centre for Biomedical Informatics, Lee Kong Chian School of Medicine, Nanyang Technological University, 50 Nanyang Avenue, Singapore 639798, Singapore 6 A*STAR Infectious Diseases Labs, Agency for Science, Technology and Research, 8A Biomedical Grove #05-13, Immunos,新加坡138648,新加坡7 Hackensack Meridian医学院,Nutley,NJ 07110,美国8铅联系 *通信 *通信:martin.gengenbacher@gmail@gmail.com
抗原 - 敏捷癌症免疫疗法的细胞因子臂树突状细胞祖细胞
树突状细胞(DC)是调节T细胞激活,运输和功能的抗原呈现的髓样细胞。用肿瘤抗原脉冲的单核细胞衍生的DC已广泛测试了癌症的治疗性疫苗接种,结果混合了临床结果。在这里,我们提出了一个基于小鼠或人类直流祖细胞(DCP)的细胞疗法平台,该平台设计为产生两种免疫刺激细胞因子IL-12和FLT3L。细胞因子臂DCP分化为常规I型DC(CDC1),并抑制了肿瘤生长,包括黑色素瘤和自肝肝模型,而无需抗原负荷或骨髓性宿主调节。肿瘤反应涉及IL-12和FLT3L之间的协同作用,并且与天然杀手和T细胞浸润和激活,M1样巨噬细胞编程和缺血性肿瘤坏死有关。抗肿瘤免疫取决于内源性CDC1的扩展和干扰素-γ信号传导,但不需要CD8 + T细胞毒性。细胞因子臂DCP与抗GD2嵌合抗原受体(CAR)T细胞有效地协同,从而消除了小鼠颅内神经胶质瘤,说明了它们在联合疗法中的潜力。
αvβ3 整合素检查点对于有效的 TH2 细胞因子极化和增强抗原特异性免疫至关重要
幼稚 CD4 + T 淋巴细胞最初经历抗原特异性激活以促进广谱反应,然后采用由细胞间微环境线索形成的定制细胞因子表达谱,从而导致以病原体为中心的模块化细胞因子反应。白细胞介素 (IL)-4 诱导的 Gata3 上调对于与抗蠕虫免疫和错误引导的过敏性炎症相关的 T 辅助细胞 2 (TH 2) 极化很重要。其他微环境因素是否参与其中尚不清楚。使用全小鼠基因组 CRISPR-Cas9 筛选,我们发现了 α v β 3 整合素在 TH 2 细胞分化中以前未被重视的作用。幼稚 CD4 + T 细胞的低水平 α v β 3 表达通过促进 TT 细胞聚集和 IL-2/CD25/STAT5 信号传导促进了泛 T 细胞活化。随后,IL-4/Gata3 诱导的 α v β 3 选择性上调允许 TH 2 细胞间 α v β 3-Thy1 相互作用,增强 mTOR 信号传导,支持分化并促进 IL-5/IL-13 产生。在小鼠中,α v β 3 是有效的过敏原驱动的抗原特异性肺 TH 2 细胞反应所必需的。因此,表达 α v β 3 的 TH 2 细胞形成多细胞工厂来传播和扩增 TH 2 反应。
探索免疫系统和炎症细胞因子在 SARS-CoV-2 诱发的肺部疾病中的作用:叙述性综述
简单总结:严重急性呼吸综合征冠状病毒 2 (SARS-CoV-2) 是导致 2019 年冠状病毒病 (COVID-19) 大流行的罪魁祸首,该病可导致严重肺炎和急性呼吸窘迫综合征 (ARDS)。免疫系统在防御 COVID-19 中起着关键作用。尽管如此,如果免疫反应失调和过度活跃,则会引发有害的“细胞因子风暴”。多项研究旨在寻找潜在的免疫调节剂来重新平衡对病毒的免疫反应,从而限制其危险影响。此外,针对 SARS-CoV-2 的疫苗研发是一项全球性挑战。本叙述性综述旨在描述 COVID-19 中免疫系统反应的最新知识,并强调主要治疗策略和疫苗的关键作用。
细胞处理技术的高级医疗产品细胞因子诱导的杀伤细胞(CIK) div>
治疗癌症患者的创新。 (免疫疗法)细胞因子诱导的杀伤细胞(CIK细胞)类型,可以刺激和增加白细胞的数量。患者刺激免疫系统消除癌细胞。有机会应对长期癌症治疗和副作用少于化学疗法治疗癌症患者的创新。 (免疫疗法)细胞因子诱导的杀伤细胞(CIK细胞)类型,可以刺激和增加白细胞的数量。患者刺激免疫系统消除癌细胞。有机会应对长期癌症治疗和副作用少于化学疗法
数学建模揭示了CAR-T细胞疗法和巨噬细胞介导的细胞因子释放综合征的时间表
嵌合抗原受体(CAR)-T细胞疗法具有巨大的癌症治疗潜力。为了了解CAR-T细胞疗法反应和CRS的时间动力学的基础机制,我们开发了一种新型的多层数学模型,该模型融合了抗原介导的CAR-T细胞扩张,抗原阴性耐药性,抗原阴性耐药性和巨噬细胞相关的细胞因子释放。考虑了巨噬细胞激活的三个关键机制:释放损伤相关的分子柱,抗原结合介导的激活和CD40-CD40L接触。该模型准确地描述了25种具有不同反应和IL-6细胞因子动力学的患者时间课程。我们成功地将响应的斗型形状与可解释的模型参数联系起来,并研究了CAR-T细胞剂量和初始肿瘤负担对CRS和治疗结果的影响。通过解散巨噬细胞激活的时间表,该模型确定了每个激活机制的不同贡献,这表明CD40-CD40L轴是CRS的主要驱动力和临床上可行的靶标,以控制激活过程并调节细胞因子峰高。我们的多层模型提供了一个综合框架,用于了解治疗过程中CAR-T细胞,肿瘤细胞和巨噬细胞之间的复杂相互作用。
系统生物学和细胞因子在肺癌免疫疗法中的潜在作用,靶向自噬轴
摘要:肺癌占全球男女死亡人数最多。尽管一种单独或与某些特定药物结合使用的广泛疗法仍然是不断发展的肺癌的主要方案,但仍需要进行显着改进,以了解渐进式侵蚀性及其检测的固有生物学。不幸的是,尽管其治疗方面有所进步,但肺癌患者表现出不同的生长机制,并继续以明显的速度死亡。自噬是一种生理防御机制,可满足营养剥夺癌细胞的能量需求,并在压力条件下维持肿瘤细胞。相反,据信自噬在肿瘤发生的不同阶段起着双重作用。在早期阶段,它充当肿瘤抑制剂,使致癌蛋白降解。但是,在后期,自噬通过最大程度地减少肿瘤微环境的应力来支持肿瘤细胞的存活。已经观察到IL6-IL17-IL23信号转导轴的关键作用是触发肺癌患者的自噬事件。由于自噬的明显作用是不同免疫信号级联反应的结果,因此系统生物学可以成为了解这些互连并增强癌症治疗和免疫疗法的有效工具。在这篇综述中,我们关注如何利用系统生物学来靶向自噬过程,从而解决炎症反应并有助于更好地治疗癌变。
抑制细胞因子风暴的仿生免疫抑制外泌体有助于缓解脓毒症
功能障碍综合征 (MODS)。[2] 在脓毒症发病机制中,炎症失调通常由 Toll 样受体 (TLR) 过度激活引发和驱动,TLR 会结合病原体相关分子模式 (PAMP) 或损伤相关分子模式 (DAMP)。[3] TLR 激活细胞内转录因子 NF- κ B,诱导促炎细胞因子(如干扰素-α、白细胞介素-6 [IL-6]、IL-8 和肿瘤坏死因子-α [TNF-α])、促凝剂和粘附分子的产生和释放,这些因子的异常产生会引发细胞因子风暴。[4,5] 反过来,细胞因子风暴会对内皮和上皮造成不可逆的损伤以及免疫细胞衰竭,最终导致器官衰竭。 [6]因此,抑制免疫过度激活是治疗脓毒症的重要策略。流行病学调查显示,实体肿瘤患者脓毒症的发生率普遍较低,不同癌症亚型的脓毒症发生率也存在很大差异,黑色素瘤患者的脓毒症发生率尤其降低,这可能与神经内分泌肿瘤的防御机制有关。[7–9]我们的初步研究结果显示,与正常小鼠相比,实验性荷瘤动物(黑色素瘤B16-F10)
对SARS病毒感染,细胞因子风暴和疫苗接种的先天和适应性免疫反应的建模
1生物医学中的数学建模跨学科中心,S.M。Nikol'skii数学研究所,俄罗斯人友谊大学(Rudn University),Miklukho-Maklaya St. 6号,117198,俄罗斯莫斯科,俄罗斯2 M&S裁决,5 Naryshkinskaya Alley,125167,俄罗斯125167,俄罗斯3号,俄罗斯3号,外国语言部3号。2, Plekhanov Russian University of Economics, 36 Stremyanny Lane, 115093 Moscow, Russia 4 Semenov Institute of Chemical Physics, 4 Kosygin St., 119991 Moscow, Russia 5 Bukhara Engineering Technological Institute, 15 Murtazoyeva Street, Bukhara 200100, Uzbekistan 6 Department of Mathematical Sciences, The University of Texas at El帕索(Paso),埃尔帕索(El Paso),德克萨斯州79902,美国7 Institut Camille Jordan,UMR 5208 CNRS,Lyon University Lyon 1,69622法国Villeurbanne,法国 *通信 *通信:cristina.leon@msdeciess.ru