XiaoMi-AI文件搜索系统
World File Search System针对含有...的质粒编码蛋白质
摘要 抗菌素耐药性 (AMR) 对人类健康构成重大威胁。尽管已经开发出疫苗来对抗 AMR,但将特定疫苗抗原与 AMR 关联起来却极具挑战性。细菌质粒在 AMR 的传播中起着至关重要的作用。我们最近的研究发现了一组细菌质粒(具体来说,IncHI 质粒),它们编码含有细菌免疫球蛋白样结构域的大分子量蛋白质。这些蛋白质位于细菌细胞的外表面,例如鞭毛或接合菌毛中。在这项研究中,我们表明这些蛋白质具有抗原性,可以保护小鼠免受携带其中一种质粒的 AMR 沙门氏菌菌株引起的感染。此外,我们成功生成了针对这些蛋白质的纳米抗体,这些纳米抗体被证明可以干扰 IncHI 质粒的接合转移。考虑到这些蛋白质也编码在其他质粒组中,例如 IncA/C 和 IncP2,针对它们可能是对抗由携带不同组 AMR 质粒的细菌引起的 AMR 感染的有效策略。由于选定的抗原与 AMR 本身直接相关,因此保护作用不仅限于特定微生物,还包括所有携带相应抗性质粒的微生物。
deplecriber-抗蛋白质Caemics
在最近的试验中证明的SGLT2抑制剂和GLP-1类似物的心血管和肾脏益处值得注意。A recent meta-analysis of these data reported a relative risk reduction (RRR) in atherosclerotic events of 12% and 11% with GLP-1 analogues and SGLT2 inhibitors respectively (almost all of this benefit was observed in patients with established atherosclerotic disease), a RRR of 31% in hospitalisation due to heart failure with SGLT2 inhibitors, and a RRR 18% and 38% in kidney GLP-1类似物和SGLT2抑制剂的疾病进展。SGLT2抑制剂可降低EGFR恶化,终阶段肾脏疾病或肾脏疾病的相对风险相关的死亡。16这些心血管和肾脏作用似乎与血糖控制无关。
蛋白质生物药物的分析
的方法用于制药释放测试,以鲁棒性和可重复性为重点。方法开发计划的目标是建立可靠的方法,并在标准操作程序(SOP)中仔细描述,该方法可以在SOLVIAS上容易执行或转移到您选择的实验室。在方法开发程序的框架内,将检查关键参数,例如线性,可重复性和LOQ,以确保可靠的分析结果。包含产品规格的书面SOP是开始方法验证程序的先决条件。方法验证程序是根据CGMP执行的
替代蛋白质全球政策状态
这些顶线数字包括宣布的一年中多年计划的全部价值,因此2023年的Topline数字没有反映在2023年之前宣布的正在进行的项目。因此,亚太地区在今年的年度数字中的代表性不足,尽管新加坡和其他地方的主要研究项目正在进行中。此外,包括中国和新加坡在内的该地区的主要资助者不会公开分享有关研究资金的完整信息。我们估计,该地区在澳大利亚,新加坡和日本的领导地位继续活跃并在2023年在该领域得到很好的代表。
蛋白质语言模型在无结构的...
理性药物设计的一个主要支柱一直是通过对接进行虚拟筛查(VS),这通常是基于结构的药物设计(SBDD)[1]。在对接中,分子配体通常通过使用生物物理定义的约束或机器学习(ML)方法在蛋白质口袋中构象构象,并且具有相应计算的结合亲和力报告的最佳姿势。典型的VS管道将通过图书馆进行迭代进行对接,通常由数百万到数十亿至数十亿个独特的化学化合物组成,并基于衍生的亲和力对配体进行对配体进行排名 - 然后得分的配体将继续进行下一个药物开发的下一个药物开发,无论是通过计算方法,例如分子动力学(MD)仿真或通过实验性验证或实验性验证[2]。
DNA,RNA和蛋白质合成
在1940年代初期,奥斯瓦尔德·艾弗里(Oswald Avery)和他的同事着手测试格里菲斯(Griffith)实验中的转化剂是蛋白质,RNA还是DNA。科学家使用酶分别破坏了热杀死的S细胞中的三个分子中的每个分子。他们使用蛋白酶在第一个实验中使用蛋白酶破坏了热杀死细胞中的蛋白质,一种称为RNase的酶在第二个实验中破坏RNA,而一种称为DNase的酶在第三个实验中销毁DNA。然后,他们分别将热杀死的S细胞的三个实验批次与活细胞混合在一起,并用混合物将小鼠注入。缺少蛋白质和RNA的细胞能够将R细胞转化为S细胞并杀死小鼠。然而,缺少DNA的细胞没有将R细胞转化为S细胞,小鼠存活。
肽和蛋白质治疗的成果
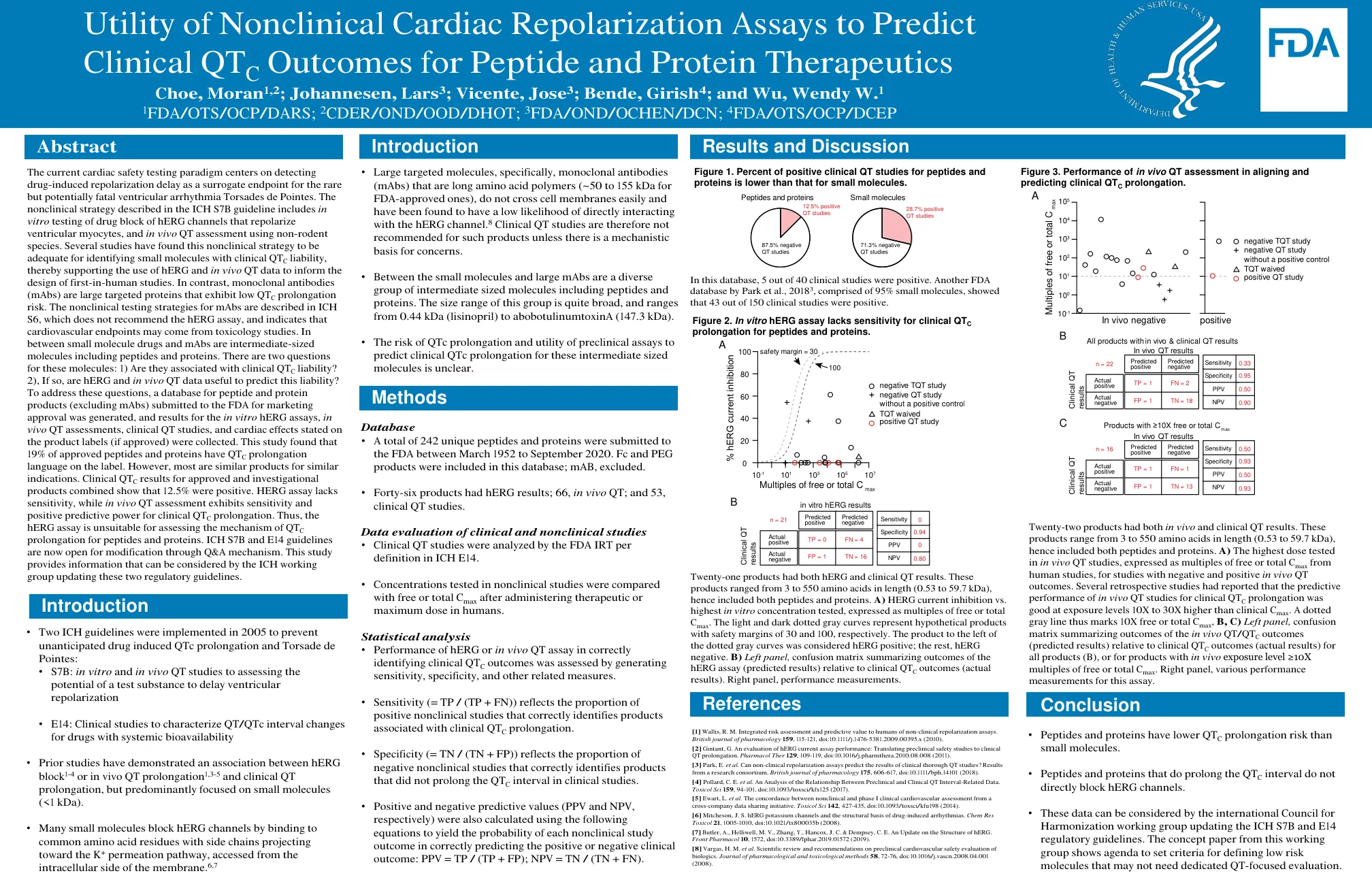
当前的心脏安全性测试范例以检测药物引起的复极延迟为中心,将其作为罕见但可能致命的室性心律失常尖端扭转型室性心动过速的替代终点。ICH S7B 指南中描述的非临床策略包括体外测试药物阻断 hERG 通道以复极心室肌细胞,以及使用非啮齿动物进行体内 QT 评估。多项研究发现,这种非临床策略足以识别具有临床 QT C 倾向的小分子,从而支持使用 hERG 和体内 QT 数据来指导首次人体研究的设计。相比之下,单克隆抗体 (mAb) 是表现出低 QT C 延长风险的大型靶向蛋白。ICH S6 中描述了 mAb 的非临床测试策略,它不推荐 hERG 检测,并表明心血管终点可能来自毒理学研究。小分子药物和 mAb 之间是中等大小的分子,包括肽和蛋白质。对于这些分子,有两个问题:1) 它们是否与临床 QT C 倾向有关?2) 如果是,hERG 和体内 QT 数据是否有助于预测这种倾向?为了回答这些问题,我们生成了提交给 FDA 以获得上市批准的肽和蛋白质产品(不包括 mAb)的数据库,并收集了体外 hERG 检测、体内 QT 评估、临床 QT 研究和产品标签上注明的心脏影响(如果已获批准)的结果。这项研究发现,19% 的获批肽和蛋白质在标签上有 QT C 延长的语言。但是,大多数是用于类似适应症的类似产品。已获批产品和研究产品的临床 QT C 结果综合显示 12.5% 为阳性。HERG 检测缺乏敏感性,而体内 QT 评估对临床 QT C 延长表现出敏感性和阳性预测力。因此,hERG 检测不适合评估肽和蛋白质的 QT C 延长机制。 ICH S7B 和 E14 指南现已开放通过问答机制进行修改。本研究提供的信息可供 ICH 工作组在更新这两项监管指南时参考。
基于蛋白质结构域的药物预测
虚拟筛选等预测方法已用于药物研发,目的是减少开发时间和成本。当前的机器学习和基于网络的方法存在与泛化、可用性或模型可解释性相关的问题,特别是由于目标蛋白的结构/功能的复杂性以及系统训练数据集的偏差。在这里,我们提出了一种新方法“DRUIDom”(DRUg 相互作用域预测),利用蛋白质的结构域模块化来识别药物候选化合物和靶标之间的生物相互作用,以克服与当前方法相关的问题。DRUIDom 由两个方法步骤组成。首先,将配体/化合物统计地映射到其靶蛋白的结构域,目的是识别它们的相互作用。这样,包含相同映射域或域对的其他蛋白质就成为相应化合物的新候选靶标。接下来,根据分子相似性对百万级小分子化合物数据集(包括上一步中映射到域的化合物)进行聚类,并将它们的域关联传播到同一聚类内的其他化合物。从公共数据库获得的经过实验验证的生物活性数据点经过精心筛选,构建活性/相互作用和非活性/非相互作用药物/化合物-靶标对的数据集(约 290 万个数据点),并用作计算化合物-域映射参数的训练数据,从而得到 250 个域和 8,165 种化合物之间的 27,032 个高置信度关联,最终输出约 500 万个新的化合物-蛋白质相互作用。通过对预测靶向 LIM-激酶蛋白的化合物进行合成和生物活性分析,对 DRUIdom 进行了实验验证,LIM-激酶蛋白在通过肌动蛋白丝动力学调节细胞运动、细胞周期进程和分化方面发挥关键作用。我们发现 LIMK-inhibitor-2 及其衍生物通过抑制 LIMK 磷酸化和下游蛋白肌动蛋白丝切蛋白,显著阻止癌细胞迁移。
基于蛋白质结构域的药物预测
虚拟筛选等预测方法已用于药物研发,目的是减少开发时间和成本。当前的机器学习和基于网络的方法存在与泛化、可用性或模型可解释性相关的问题,特别是由于目标蛋白的结构/功能的复杂性以及系统训练数据集的偏差。在这里,我们提出了一种新方法“DRUIDom”(DRUg 相互作用域预测),利用蛋白质的结构域模块化来识别药物候选化合物和靶标之间的生物相互作用,以克服与当前方法相关的问题。DRUIDom 由两个方法步骤组成。首先,将配体/化合物统计地映射到其靶蛋白的结构域,目的是识别它们的相互作用。这样,包含相同映射域或域对的其他蛋白质就成为相应化合物的新候选靶标。接下来,根据分子相似性对百万级小分子化合物数据集(包括上一步中映射到域的化合物)进行聚类,并将它们的域关联传播到同一聚类内的其他化合物。从公共数据库获得的经过实验验证的生物活性数据点经过精心筛选,构建活性/相互作用和非活性/非相互作用药物/化合物-靶标对的数据集(约 290 万个数据点),并用作计算化合物-域映射参数的训练数据,从而得到 250 个域和 8,165 种化合物之间的 27,032 个高置信度关联,最终输出约 500 万个新的化合物-蛋白质相互作用。通过对预测靶向 LIM-激酶蛋白的化合物进行合成和生物活性分析,对 DRUIdom 进行了实验验证,LIM-激酶蛋白在通过肌动蛋白丝动力学调节细胞运动、细胞周期进程和分化方面发挥关键作用。我们发现 LIMK-inhibitor-2 及其衍生物通过抑制 LIMK 磷酸化和下游蛋白肌动蛋白丝切蛋白,显著阻止癌细胞迁移。
发现针对蛋白质的药物的挑战–...
经典的“小分子”药物研发方法主要关注小配体与酶、离子通道和受体等蛋白质之间的相互作用,因为这些蛋白质通常含有明确的配体结合位点,小分子可以与之相互作用[1,2]。该方法在很大程度上忽略了蛋白质-蛋白质相互作用(PPI),原因是小分子对PPI的调节具有挑战性[2-5]。相反,人们使用诸如免疫共沉淀、下拉分析、交联、标记转移、远Western印迹分析、核磁共振、X射线晶体学和大规模蛋白质组学等方法来表征PPI[6]。这种表征非常重要,因为PPI对蛋白质功能至关重要,并在生命过程中发挥着举足轻重的作用。毫不奇怪,它们会导致许多疾病,因为它们可能导致蛋白质复合物在本不应该聚集在一起或解体的时候聚集在一起或解体。事实上,异常的PPI与各种疾病有关,包括癌症、传染病和神经退行性疾病。然而,与球状蛋白与细胞内其他分子的相互作用相比,PPI更难在治疗上进行靶向治疗,因为一般来说,相互作用蛋白之间的界面 (i) 高度疏水性,大于通常的受体-配体接触面积[7],(ii) 平坦,几乎没有用于设计抑制分子的凹槽,(iii) 具有以高亲和力相互结合的氨基酸残基,小分子很难抑制 [8]。尽管如此,靶向PPI越来越被视为开发治疗疾病的新药的一种有前途的策略[9,10]。最近,PPI 调节剂已经进入临床研究,其中一些已获批上市,这表明靶向PPI 的调节剂具有良好的前景([2]及其中的参考文献)。