XiaoMi-AI文件搜索系统
World File Search System致命的肌动蛋白崩溃,二硫酸
细胞在敌对或营养不足的环境中生存的主要挑战之一,例如肿瘤微环境,是由代谢失衡或快速增殖引起的活性氧(ROS)缓冲活性氧(ROS)。过多的ROS的细胞需要产生保护性分子,例如谷胱甘肽,以减轻破坏性作用。谷胱甘肽的产生需要半胱氨酸,通常通过SLC7A11胱氨酸 - 谷氨酸抗虫剂从细胞外环境中吸收氧化二聚体形式,胱氨酸。如果胱氨酸的摄取被阻断,细胞会经历铁毒性,这是由磷脂过氧化引起的铁依赖性死亡,尤其是多不饱和脂肪酸(PUFA),导致质膜膜中的广泛异常。铁凋亡通过白介素释放(IL-1和IL-18)激活免疫系统,并与炎症性疾病和伤害有关(1次审查1)。为了避免铁铁作用,许多癌症上调了SLC7A11,并进口大量胱氨酸以进行有效的谷胱甘肽生产。然而,这还需要准备好通过五磷酸五磷酸途径生产NADPH的葡萄糖,以便可以减少胱氨酸以降低用于谷胱甘肽生物合成(图1)。
构建谷胱甘肽响应性紫杉醇前药纳米粒子用于图像引导靶向递送和乳腺癌治疗
以提高代谢稳定性和实时监测药物位置。基于多糖的纳米前药由于其成分清晰、结构准确、载药量稳定、抗肿瘤活性高而受到广泛关注。14,15壳聚糖(CS)是一种天然无毒的高分子材料,具有良好的生物降解性和生物相容性,被广泛应用于抗肿瘤药物的递送,用于癌症的诊断和治疗。16,17此外,CS具有大量的氨基(-NH 2)和羟基(-OH),是极好的功能化修饰位点。18如果将疏水性抗癌药物通过共价键直接偶联到亲水性聚合物链上,可以大大防止药物过早释放。然而,以壳聚糖为基础形成的阳离子纳米粒子不仅缺乏肿瘤靶向作用,而且易受血清蛋白介导的聚集和消除。19 透明质酸具有天然电负性,可用于包覆阳离子基纳米粒子。同时,透明质酸由于其低免疫原性,高生物相容性以及靶向肿瘤特异性表达受体(簇决定簇44,CD44)而被用于药物递送系统。20 因此,HA功能化的药物递送系统可以主动靶向癌细胞。21,22
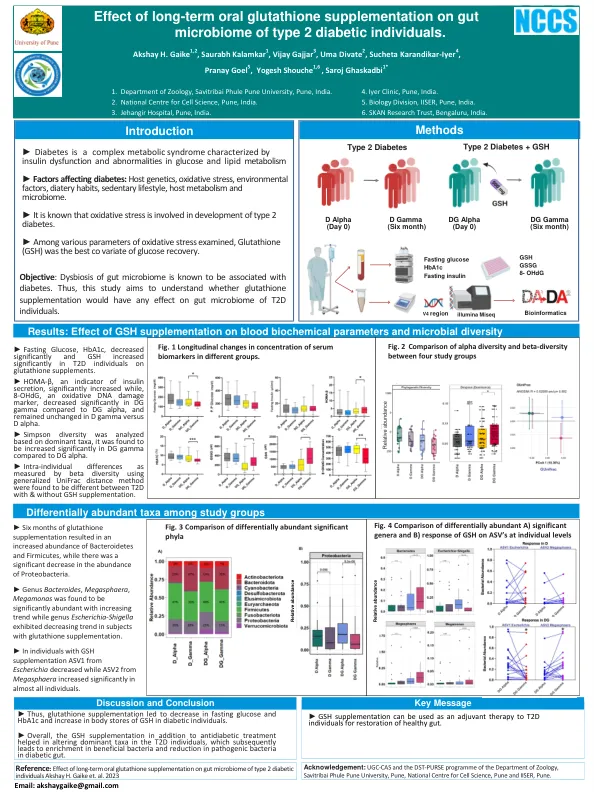
参考:长期补充谷胱甘肽对2型糖尿病个体Akshay H. Gaike等的肠道微生物组的影响。 al。 2023
►禁食葡萄糖HBA1C显着降低,谷胱甘肽补充剂T2D个体的GSH显着增加。►HOMA-β,一种胰岛素分泌的指标,显着增加,而与DGα相比,DG Gamma的8-OHDG(一种氧化性DNA损伤标志物在DG Gamma中显着下降,并且在D Gamma vess v and d alpha中保持不变。►根据显性群体分析了Simpson的多样性,与DGα相比,DG Gamma中发现它在DG Gamma中显着增加。►通过beta多样性使用广义unifrac距离方法测量的个体内差异在t2d之间有所不同,并具有补充GSH。
深水pinnipeds大脑中的抗氧化剂防御
觅食时,海洋哺乳动物进行了重复的潜水。当动物表面再灌注时,将氧气容易地用于电子传输链,这会导致活性氧的产生增加,并有氧化损伤的风险。在血液和多种组织中,例如心脏,肺,肌肉和肾脏,海洋哺乳动物通常表现出抗氧化剂的升高。但是,功能完整性对于生存至关重要的大脑很少受到关注。我们先前观察到在连帽密封(Cystophora cristata)的皮质神经元中,几种抗氧化基因的表达增强。在这里,我们研究了竖琴密封(Pagophilus groenlandicus)和带帽密封的视觉皮层,小脑和海马中的抗氧化基因表达和酶活性。此外,我们测试了几个基因的阳性选择。我们发现,与小鼠(Mus Musculus)相比,海豹脑中的抗氧化剂(例如超氧化物歧化酶(SOD)(SOD),谷胱甘肽过氧化物酶(GPX)和谷胱甘肽(GSH)相比,海豹脑中的组成型增强了。可能是后一种系统的活性是应力诱导的,而不是组成型的。此外,谷胱甘肽 - 转移酶(GST)家族的一些但不是全部成员似乎更加表达。我们没有发现阳性选择的签名,表明所研究的抗氧化剂的序列和功能是在pinnipeds中保守的。
黑色素瘤细胞的铁死亡易感性
缩写:SMA,α平滑肌肌动蛋白;AA,氨基酸;BME,Eagle基础培养基;BMP4,骨形态发生蛋白-4;BFP,蓝色荧光蛋白;CoQH2,还原辅酶Q;CHP,氢过氧化异丙苯;DR,耐药;EBSS,Earle平衡盐溶液;EGF,表皮生长因子;FBS,胎牛血清;eIF2,真核起始因子2α;FACS,荧光激活细胞分选术;FITC,异硫氰酸荧光素;GAPDH,3-磷酸甘油醛脱氢酶;GFP,绿色荧光蛋白;GSH,谷胱甘肽;GSSG,谷胱甘肽二硫化物;GPX4,谷胱甘肽过氧化物酶4;HGF,肝细胞生长因子;HPLM,人血浆样培养基; iRFP,近红外荧光蛋白;Mel-MPM,黑色素瘤导向模块化生理培养基;MPM,模块化生理培养基;NAD,烟酰胺腺嘌呤二核苷酸;NAMPT,烟酰胺磷酸核糖转移酶;NAMPTi,烟酰胺磷酸核糖转移酶抑制剂;NEAA,非必需氨基酸;NHDF,正常人真皮成纤维细胞;PI,碘化丙啶;ROS,活性氧;Se,亚硒酸盐;SLC3A2,溶质载体家族 3 成员 2;SLC7A11,溶质载体家族 7 成员 11;xCT,胱氨酸/谷氨酸转运蛋白
糖尿病性肾病Wistar大鼠的喂养脂肪多氧化锌氧化锌纳米颗粒乳液对谷胱甘肽过氧化物酶和抗胰岛素产生的影响
T.多元化是从印度尼西亚中部爪哇省马格兰市的农村地区获得的。该植物由Penelitian实验室Dan Pengujian Terpadu(LPPT),Gadjah Mada大学(UGM)确定。按照Muniroh等人概述的方法,使用70%乙醇通过70%乙醇提取多元链球菌的叶子。[12]。随后,通过将1.5 g硫酸锌七含锌硫酸盐溶解在162.5 mL的蒸馏水中,并将2 g羟基氧化钠溶解在50 mL的去离子水液滴中,并将2 g羟基氧化钠溶于162.5 ml的蒸馏水中,从而合成氧化锌(ZnO)纳米颗粒。将沉淀物过滤,用纯净水洗涤,在60°C下干燥24小时,并在400°C下凝固2小时。对于乳液,将7.5毫升的原始椰子油,52.5毫升的补间和25 mL聚乙烯甘油加热至70°C。水相逐渐添加到油相中,同时连续搅拌直至发生皂化。ZnO纳米晶体的浓度为1%。T.多样化锌 - 氧化物纳米颗粒(TDNP)乳液是通过将T. diversifolia提取物溶液与ZnO溶液中的9:1比混合而成制备的,从而浓度为1 mm。然后将混合物在28°C下搅拌几个小时[13]。
钌在医学中的应用:当前临床应用及未来前景
钌化合物具有相对八面体几何结构,并且 R ug 复合物往往比相关的 R um 和 (IV) 复合物更具生物惰性。复合物的氧化还原电位可以通过改变配体来改变。在生物系统中,谷胱甘肽、抗坏血酸和单电子转移蛋白能够还原 Ru(IIl) 和 R um ,而分子氧和细胞色素氧化酶容易氧化 Rum。钌化合物的氧化还原电位可用于提高临床药物的有效性。例如,药物可以作为相对惰性的 Ru(I1I) 复合物施用,这些复合物通过患病组织中的还原而激活。在许多情况下,与癌症和微生物感染相关的代谢改变导致这些组织中的氧浓度低于健康组织,从而促进还原环境。已知癌细胞具有较高水平的谷胱甘肽和
靶向铁死亡:一种克服乳腺癌耐药性的有前途的策略
乳腺癌是全球女性最常见的恶性肿瘤之一,其发病率在年轻人群中越来越高。近年来,耐药性已成为乳腺癌治疗的一大挑战,因此,耐药性成为当代研究的焦点,旨在寻找解决这一问题的策略。越来越多的证据表明,通过各种机制诱导铁死亡,特别是通过抑制系统 Xc -、消耗谷胱甘肽 (GSH) 和灭活谷胱甘肽过氧化物酶 4 (GPX4),在克服乳腺癌耐药性方面具有巨大潜力。预计针对铁死亡的疗法将成为逆转肿瘤耐药性的有希望的策略,为乳腺癌患者带来新的希望。本综述将探讨在乳腺癌耐药性背景下理解铁死亡的最新进展,特别强调铁死亡诱导剂和抑制剂的作用,以及铁死亡途径对克服乳腺癌耐药性的影响。
1H核磁共振(NMR)
结果:吗啡引起MPFC和NAC中许多代谢产物的浓度的显着变化。MPFC和NAC中谷氨酰胺 - 谷氨酸-GABA兴奋性抑制周期的谷氨酰胺成分增加。在MPFC上也观察到谷氨酸的显着增加,但在NAC中却没有观察到。在MPFC和NAC中,磷酸化,能量代谢标记和神经元生存力和能量代谢的N-乙酰天冬氨酸标记显着降低。甘油磷胆碱 +磷酸,细胞膜完整性的标志物在吗啡后的NAC和MPFC中显着增加。NAC中的抗氧化神经量代谢物牛磺酸和谷胱甘肽显着增加。然而,牛磺酸减少,吗啡后MPFC中的谷胱甘肽不变。肌醇,一种神经炎症的标志物,在NAC中显着增加。
GSTM1/GSTT1 多态性对南印度人群 2 型糖尿病患者心血管疾病风险的预后作用
心血管疾病 (CVD) 是 2 型糖尿病 (T2DM) 的一个严重并发症,氧化应激在其中起着重要作用。谷胱甘肽 S-转移酶 (GST) 多态性 - GSTM1、GSTT1 - 与 CVD 和 T2DM 有关。本研究调查了 GSTM1 和 GSTT1 在南印度人口的 T2DM 患者中 CVD 发展中的作用。