XiaoMi-AI文件搜索系统
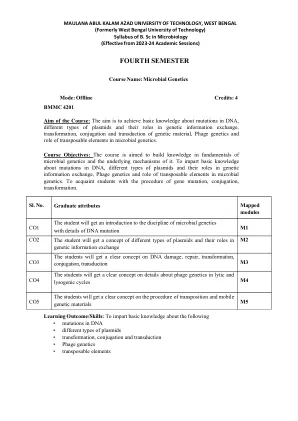
World File Search SystemNEP_SYLLABUS_MICROBIOLOGY_4TH SEM.docx
遗传交换机制 DNA 作为遗传物质:格里菲斯转化实验、艾弗里、麦克劳德和麦卡锡实验、赫尔希和蔡斯实验证明 DNA 携带遗传信息。弗兰克尔-康拉特实验证明 RNA 是遗传物质。原核生物染色体的结构和组织。质粒类型、原核生物中的转座子。细菌转化:原核生物中发现的转化机制的原理和类型。细菌结合:U 型管实验、F 质粒的特性、F + x F - 结合、Fʹ x F - 结合、Hfr x F - 结合、转导:广义和专门的转导
支原体的基因编辑工具
支原体是一种成功的致病菌,可导致人类和各种动物宿主的衰弱性疾病。尽管支原体基因组极其精简,但它们已经进化出特殊的机制来从宿主细胞中获取必需的营养物质。用于操纵支原体基因组的遗传工具的匮乏阻碍了对致病菌种的毒力因子和营养物质获取机制的研究。本文总结了几种编辑支原体基因组的策略,包括同源重组、转座子、成簇的规律间隔短回文重复序列 (CRISPR)/Cas 系统和合成生物学。此外,本文还讨论了不同工具的机制和特点,以期为高效操纵支原体基因组提供参考和未来方向。
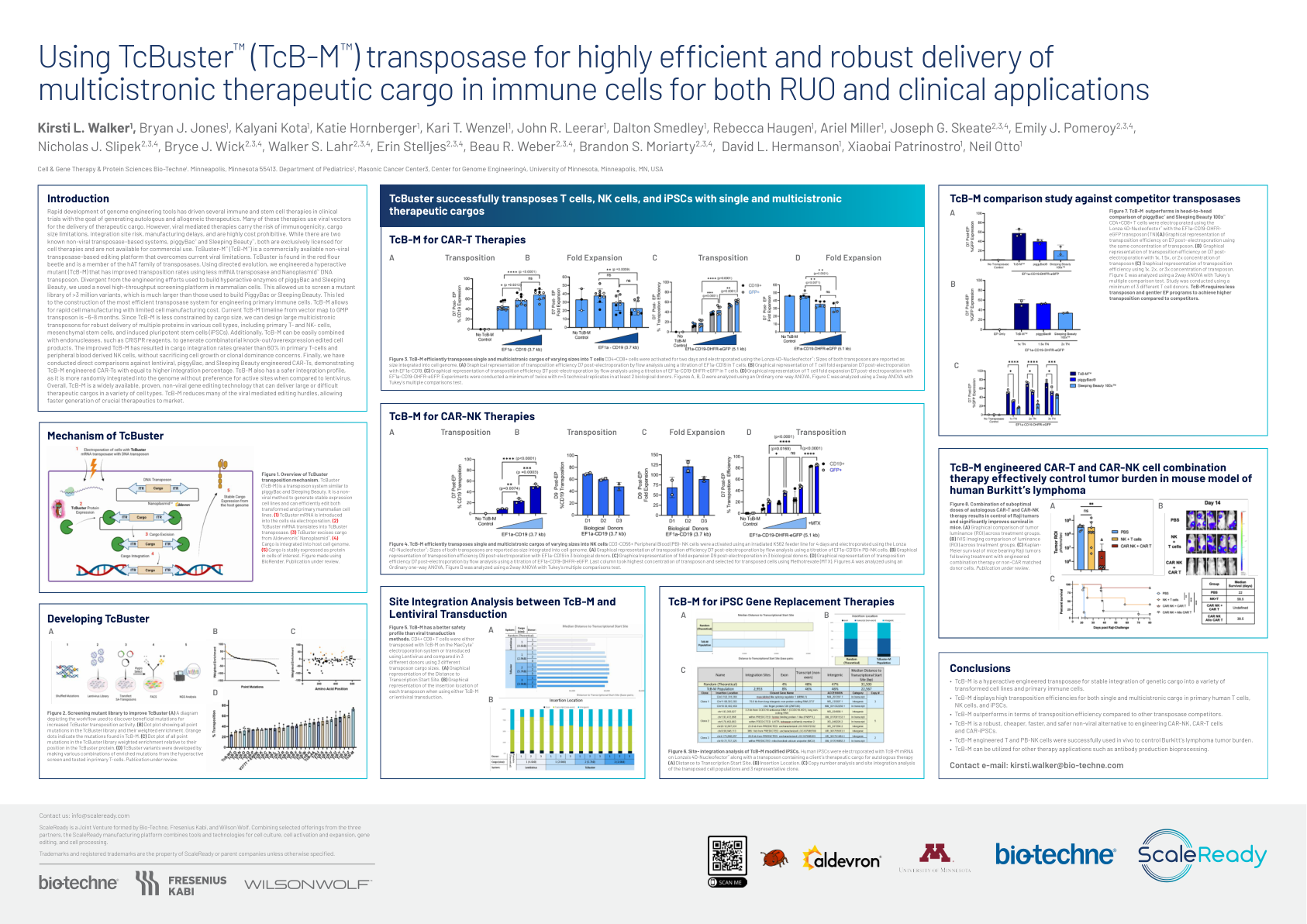
使用TcBuster™ (TcB-M™) 转座酶实现高效...
基因组工程工具的快速发展推动了多种免疫和干细胞疗法进入临床试验,目的是产生自体和同种异体疗法。这些疗法中的许多都使用病毒载体来运送治疗货物。然而,病毒介导的疗法具有免疫原性、货物大小限制、整合位点风险、制造延迟的风险,并且成本极高。虽然有两种已知的非病毒转座酶系统 piggyBac ® 和 Sleeping Beauty ™ ,但两者都被专门授权用于细胞疗法,不能用于商业用途。TcBuster-M ™ (TcB-M ™ ) 是一种可商购的非病毒转座酶编辑平台,可克服当前的病毒限制。TcBuster 存在于赤拟谷盗中,是 hAT 转座酶家族的成员。利用定向进化,我们设计了一种高活性突变体 (TcB-M),使用更少的 mRNA 转座酶和 Nanoplasmid ™ DNA 转座子提高了转座率。与用于构建 piggyBac 和 Sleeping Beauty 高活性酶的工程努力不同,我们在哺乳动物细胞中使用了一种新型高通量筛选平台。这使我们能够筛选一个包含 >300 万个变体的突变体库,这比用于构建 PiggyBac 或 Sleeping Beauty 的突变体库大得多。这导致构建了用于设计原代免疫细胞的最有效的转座酶系统。TcB-M 允许快速制造细胞,并且细胞制造成本有限。目前,从载体图谱到 GMP 转座子的 TcB-M 时间约为 6-8 个月。由于 TcB-M 受货物尺寸的限制较少,我们可以设计大型多顺反子转座子,以便在各种细胞类型中稳定地递送多种蛋白质,包括原代 T 细胞和 NK 细胞、间充质干细胞和诱导性多能干细胞 (iPSC)。此外,TcB-M 可以轻松与内切酶(如 CRISPR 试剂)结合,以生成组合敲除/过表达编辑细胞产物。改进的 TcB-M 使原代 T 细胞和外周血来源的 NK 细胞中的货物整合率超过 60%,而不会牺牲细胞生长或克隆优势问题。最后,我们对慢病毒、piggyBac 和 Sleeping Beauty 工程化 CAR-T 进行了直接比较,表明 TcB-M 工程化 CAR-T 具有同等或更高的整合百分比。TcB-M 还具有更安全的整合特性,因为与慢病毒相比,它更随机地整合到基因组中,而没有对活性位点的偏好。总体而言,TcB-M 是一种广泛可用、经过验证的非病毒基因编辑技术,可在多种细胞类型中递送大量或难以处理的治疗物质。TcB-M 减少了许多病毒介导的编辑障碍,从而可以更快地生成关键的治疗方法并将其推向市场。
细菌 CRISPR 筛选基因功能
细菌基因组组装的指数级增长以及研究细菌生命多样性的重要性日益增加,导致人们越来越关注功能基因组学方法。通过将基因组规模的遗传扰动与高通量表型分析相结合,功能基因组学系统地定义了基因-表型关系,从而可以推断未知功能基因的功能。存在几种用于扰动基因功能的高通量方法,包括基于转座子的方法(例如 Tn-seq 和 TraDIS)、敲除收集和 CRISPR 方法。这些方法各有优缺点,并且通常以互补的方式部署。然而,我们对 CRISPR 理解的进步、DNA 合成成本的降低以及新的 CRISPR 模式已导致 CRISPR 被广泛用于整个细菌领域的功能基因组学研究。
微生物学和细菌遗传学的作用
(CG)编码抗生素耐药性。主要由EGMS(例如质粒,转座子和冰)佩戴,IRS在很大程度上参与了革兰氏阴性细菌中抗生素耐药性的传播。IRS的关键要素是Inti的整合,它催化了CG的整合和切除,并且其表达是由诱导SOS反应(包括抗生素应力)的应力引起的。我们最近强调,生物膜的生活方式(彼此粘附和表面的细菌)会产生足够的压力,以诱导SOS响应和Integasse Inti的表达,以少量的生物膜细菌(1%),从而允许IR通过IR被IR重新进行CG的收购和重新排列。在环境中,由于人为污染,细菌通常也会暴露于亚抑制浓度的抗生素。这些浓度在抗性传播能力上的作用仍然未知。
基因工程小麦在全球范围内传播
英国研究人员使用CRISPR/CAS作为NGT小麦的工具。科学家已经开发了一种称为Tegnesis的新突变程序。它在植物中的两种化学物质的帮助下动员了如此被称为的跳跃基因(转座子),因此旨在加速植物对应激条件的适应。用Tgenenesis处理的相应的冬小麦希望从秋天和选择线的抗态线上生长大农镜。瑞士联邦环境办公室的批准仍在审理中。瑞士Allianz Gentech-Frei除了应用程序中的技术缺陷以及可能的利益外,还批评了测试经理发明了专利的方法,并共同创立了一家公司以进行独家营销。上周,瑞士议会的16名国会议员向国家议会提交了询问。
使用药物盒在体内淘汰基因
“基因敲除”或“敲除”是一种使基因功能失活的突变。这些突变对于经典的遗传研究以及包括功能基因组学在内的现代技术非常有用。过去,细菌基因的敲除通常是通过转座子诱变做出的。在这种情况下,需要费力的屏幕才能找到感兴趣的基因的淘汰赛。传统上,首先使用体外基因工程来修改质粒或细菌性人工染色体(BAC)的基因,然后将这些修饰的构建体移至细胞培养技术感兴趣的生物。利用基因工程和体内同源重组的组合的其他方法充其量效率低下。重新组合提供了一种直接在细菌染色体上产生基因敲除突变的新方法,或者将体内任何质粒或BAC修改为在其他生物体中敲除的前奏。构造设计为基础对,
古细菌DNA-Import仪器与细菌共轭机械同源
结合是水平基因转移的主要机制,促进了抗生素耐药性在人类病原体中的传播。它涉及通过称为交配菌毛的细胞外附属物来避免供体和受体细胞之间的连接。在细菌中,结合机制由质粒或转座子编码,通常介导同源移动遗传元件的转移。对古细菌的共轭知之甚少。在这里,我们通过三个共轭pili的冷冻电子显微镜确定原子结构,两种来自高疗法古细菌(Aeropyrum pernix和pyrobaculum calidifontis),另一个由一个由细菌的细菌ti toumefaciial to to to to to to to to to to to to to to toumefacial-to to to to to to to to to to toumefiti。 pili。然而,古细菌共轭机制(称为CED)已被“驯化”,即结合机械的基因编码在染色体上,而不是在移动遗传元素上,并介导细胞DNA的转移。
Charalambos Savakis,医学博士PhD
minos是果蝇海德(Drosophila Hydei)的TC 1型型2型转座元件,在克里特郡IMBB的Savakis实验室中发现。我小组的工作表明,MINOS可以在各种无脊椎动物,人培养细胞以及小鼠体细胞和生殖线细胞中转置。minos-主要的农业害虫塞拉蒂炎,ceratitis ceratiso ceratitis介导的生殖系转化,是转座子介导的果蝇和米诺斯以外的昆虫中转座介导的转基因的首次演示,用于转化蚊子蚊子和橄榄蝇菌(DACUS)。Minos基于果蝇中基于果蝇中的插入诱变现在被确定为该模型生物体中基因组功能分析的重要工具。
微生物学
M.M. 50单元质膜和跨膜的转运,能量转化,细菌生长的生理学,生长阶段,生长条件,细菌细胞孢子孢子的分化,发芽;细菌细胞分裂复制染色体,染色体分隔为女儿Cel。 第一单位和继发代谢。 单位II1细菌质粒;结构和支撑物,复制,不纠正,质粒扩增。 噬菌体;裂解开发周期T4;噬菌体,单链DNA噬菌体的裂解和溶菌发生。 换位;细菌转座子的结构,细菌转子的类型。 抗生素耐药性和抗生素耐药性的矛盾机制。 单元IV基因重组;需求,分子基础,细菌重组的遗传分析。 单位V DNA修复和限制;维修系统的类型,限制性核酸内切酶,各种类型的限制酶,大坝和DCM甲基酶。 T.A.教科书基因克隆 棕色。 Power和Daganiwala的一般微生物学。 Zinssers Microbiology撰写的KJ Wolfgang,McGraw-Hjill Company。 4。 RM Stanley,F David和EC John的微生物遗传学。 5。 FJ Baker的细菌学技术。M.M.50单元质膜和跨膜的转运,能量转化,细菌生长的生理学,生长阶段,生长条件,细菌细胞孢子孢子的分化,发芽;细菌细胞分裂复制染色体,染色体分隔为女儿Cel。第一单位和继发代谢。单位II1细菌质粒;结构和支撑物,复制,不纠正,质粒扩增。 噬菌体;裂解开发周期T4;噬菌体,单链DNA噬菌体的裂解和溶菌发生。 换位;细菌转座子的结构,细菌转子的类型。 抗生素耐药性和抗生素耐药性的矛盾机制。 单元IV基因重组;需求,分子基础,细菌重组的遗传分析。 单位V DNA修复和限制;维修系统的类型,限制性核酸内切酶,各种类型的限制酶,大坝和DCM甲基酶。 T.A.教科书基因克隆 棕色。 Power和Daganiwala的一般微生物学。 Zinssers Microbiology撰写的KJ Wolfgang,McGraw-Hjill Company。 4。 RM Stanley,F David和EC John的微生物遗传学。 5。 FJ Baker的细菌学技术。单位II1细菌质粒;结构和支撑物,复制,不纠正,质粒扩增。噬菌体;裂解开发周期T4;噬菌体,单链DNA噬菌体的裂解和溶菌发生。换位;细菌转座子的结构,细菌转子的类型。抗生素耐药性和抗生素耐药性的矛盾机制。单元IV基因重组;需求,分子基础,细菌重组的遗传分析。单位V DNA修复和限制;维修系统的类型,限制性核酸内切酶,各种类型的限制酶,大坝和DCM甲基酶。T.A.教科书基因克隆棕色。Power和Daganiwala的一般微生物学。Zinssers Microbiology撰写的KJ Wolfgang,McGraw-Hjill Company。4。RM Stanley,F David和EC John的微生物遗传学。5。FJ Baker的细菌学技术。