XiaoMi-AI文件搜索系统
World File Search System小儿特应性皮炎和食物过敏的皮肤微生物组
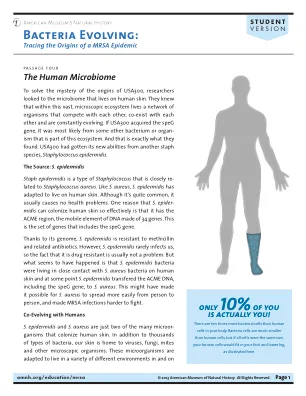
fi g u r e 1在健康或患病的皮肤中,金黄色葡萄球菌,天然皮肤分子和宿主细胞之间的相互作用。在健康的皮肤上(左),诸如凝聚酶阴性葡萄球菌(CONS)和真菌Malassezia等共生分泌多种化合物,以抑制金黄色葡萄球菌的生长(S. aureus)。分泌苯酚可溶蛋白(PSM)和自动诱导肽,它们分别抑制金黄色葡萄球菌的生长和毒力因子的表达。缺点可以刺激宿主表皮细胞产生抗微生物肽(AMP),以进一步抑制金黄色葡萄球菌的生长。CONS和CONSAL MALASSEZIA也分泌各种蛋白酶,这些蛋白酶破坏了金黄色葡萄球菌生物膜的形成。这些机制有助于T细胞耐受性,并可能优化健康皮肤上的屏障功能。但是,尚不清楚这些蛋白酶是否也可能在某种程度上破坏宿主屏障。在发炎的皮肤上(右),金黄色葡萄球菌定植和生物膜形成增加会导致毒力因子的分泌增加,例如PSMS,毒素和蛋白酶,损害了角膜层。主机放大器的存在较低,或者由于金黄色葡萄球菌的活性和Th2信号传导而效果较低。S.金黄色葡萄球菌还可以抑制皮肤分子的生长或活性。超抗原可以穿透表皮并触发皮肤树突状细胞,以驱动T辅助2(Th2)极化和膨胀。虽然没有发炎的前剥皮皮肤(中间),但抑制金黄色葡萄球菌的份量可能会下降,可能促进过渡到致病状态。多数TH2细胞又产生多种促炎性细胞因子,这进一步加剧了皮肤屏障功能障碍,B细胞产生IgE和肥大细胞脱粒。与健康的皮肤相比,这些人的Th2反应升高和IgE升高,并且在随后的耀斑中倾向于严重的瘙痒。(使用biorender.com创建)。
20231219_limmatech_abvacc-staph_pr_final-3.pdf
Schlieren (Zurich) and Rockville (Maryland), December 19, 2023 – LimmaTech Biologics and AbVacc announced today a license agreement that grants LimmaTech the exclusive rights to further develop AbVacc's multivalent toxoid vaccine candidate, LBT- SA7 (formerly IBT-V02), designed to prevent infections caused by the bacterial pathogen, Staphylococcus金黄色(S.金黄色葡萄球菌)。Limmatech还收到了独家选项,即可执行后的第1阶段读取,以获得该计划的全部权利。尚未披露交易的更多细节。LBT-SA7是六个六毒素疫苗候选者,迄今为止由ABVACC设计和开发,用于预防由金黄色葡萄球菌引起的复发皮肤和软组织感染(SSTI)。候选疫苗含有弱的毒素形式,称为毒素,通常由病原体分泌引起感染的病原体。LBT-SA7的独特配方使人体能够通过引起对原始金黄色葡萄球菌毒素的免疫反应来与感染作斗争。小鼠和兔子的临床前研究表明,对金黄色葡萄球菌感染的几种临床相关形式表现出强烈的中和活性。疫苗候选者还显示出在病原体中暴露于未经病原体的非疫苗中的功效。“ S.金黄色葡萄球菌相关的感染仍然是紧急的全球医疗优先事项,目前尚无疫苗。我们高度重视Limmatech团队的经验深度和基于ABVACC产生的原始科学工作和有希望的临床前数据,我们旨在快速开始临床开发,并为具有广泛金黄色葡萄球菌感染的患者进行有效的干预措施。“基于我们广泛的疫苗开发专业知识,包括反对金黄色葡萄球菌,将该计划添加到我们的管道中是我们策略的关键里程碑,以采取创新方法,以防止越来越多的微生物感染,并对抗菌耐药性的危险崛起产生积极影响。” ABVACC总裁兼首席科学官Javad Aman博士说:“该产品候选人有可能通过有效防止其复发来解决对SSTIS的紧迫医疗需求。
NGS 2024口头抽象演示内容和时间表
Phylogenomic analysis of colonizing and invasive Staphylococcus aureus in a neonatal intensive care unit reveals high levels of transmission of invasive strains Presenter: Qianxuan She , MS, University of Pennsylvania/Children's Hospital of Philadelphia Abstract Body: Background: Staphylococcus aureus is a leading cause of healthcare-associated infection.金黄色葡萄球菌的无症状定植代表了随后感染的重要风险。 最近的数据表明,金黄色葡萄球菌仍然是与新生儿重症监护病房(NICU)中感染有关的最常见病原体之一。 金黄色葡萄球菌在NICU中的殖民化和传播可能代表这种高危人群中感染的重要风险。 方法:这项研究利用了1,264个定居和浸润性金黄色葡萄球菌分离株的全基因组测序,该分离株是从NICU在费城儿童医院住院的婴儿中收集的两年筛查期。 进行了比较基因组分析和基因组流行病学方法,以研究NICU环境中金黄色葡萄球菌的传递动力学。 结果:比较基因组分析确定了73个单核苷酸多态性(SNP)阈值,以证明NICU S.金黄色葡萄球菌基因组之间紧密的克隆种群结构。 在此截止中,鉴定了460个独特的菌株,主要属于克隆综合体8和398。 59个传播簇被推断出,有16个侵入性簇涉及133名婴儿。 最大的侵入性簇涉及24名婴儿,持续了2年。 口头抽象演示#2:代表了随后感染的重要风险。最近的数据表明,金黄色葡萄球菌仍然是与新生儿重症监护病房(NICU)中感染有关的最常见病原体之一。金黄色葡萄球菌在NICU中的殖民化和传播可能代表这种高危人群中感染的重要风险。方法:这项研究利用了1,264个定居和浸润性金黄色葡萄球菌分离株的全基因组测序,该分离株是从NICU在费城儿童医院住院的婴儿中收集的两年筛查期。进行了比较基因组分析和基因组流行病学方法,以研究NICU环境中金黄色葡萄球菌的传递动力学。结果:比较基因组分析确定了73个单核苷酸多态性(SNP)阈值,以证明NICU S.金黄色葡萄球菌基因组之间紧密的克隆种群结构。在此截止中,鉴定了460个独特的菌株,主要属于克隆综合体8和398。59个传播簇被推断出,有16个侵入性簇涉及133名婴儿。最大的侵入性簇涉及24名婴儿,持续了2年。口头抽象演示#2:从定植到侵入性簇的进展,可能是由于无法消除定殖菌株的促进。在一些集群中发现了空间流行病学联系,这表明共享NICU房间的婴儿的传播,并且可能通过患者入院引入一些侵入性簇。与定居簇相比,侵入性簇表现出长时间的持久性和增强性,导致在特定时间范围内涉及的患者数量增加。结论:这些分析已经阐明了NICU S.金黄色葡萄球菌基因组之间的基因组相同性,并表征了已识别透射簇簇的流行病学联系。我们的发现表明,殖民,传播和侵入性感染的发展之间存在明显的关联,强调实施有效的预防和非殖民化策略以解决NICU环境中的金黄色葡萄球菌感染的重要性。
角质形成细胞和中性粒细胞之间的相互作用决定了皮肤对金黄色葡萄球菌感染的免疫力
皮肤免疫屏障依赖于不同细胞类型之间的相互作用,以确保生理条件下的体内平衡并防止病原体入侵(1)。角质形成细胞是表皮的主要成分,因此是感知金黄色葡萄球菌(S. aureus)等入侵病原体的第一个细胞,因此在启动和维持皮肤炎症方面起着至关重要的作用(2)。它们含有模式识别受体,有助于感知微生物上的病原体相关分子模式(PAMP),从而启动细胞因子、趋化因子和抗菌肽(AMP)的分泌,并将免疫细胞募集到感染部位(2)。多形核中性粒细胞(PMN)是人体血液中最丰富的白细胞(3)。皮肤感染后,PMN 是第一批进入感染部位的细胞,在感染部位提供有效的第一道防线 (4,5)。为了确保感染部位快速反应,PMN 含有储存在细胞质颗粒中的预制分子,这些分子可通过脱颗粒快速动员 (6,7)。然而,过度脱颗粒会对周围组织造成巨大的附带损害,并导致全身炎症。因此,PMN 活化和脱颗粒需要严格控制,并需要受体偶联机制 (6)。完成任务后,PMN 会发生凋亡并被巨噬细胞清除。这可以防止过度炎症并有助于恢复体内平衡 (8-10)。金黄色葡萄球菌是一种革兰氏阳性兼性病原体,是人类大多数皮肤感染的罪魁祸首。它无症状
来自特应性皮炎患者和健康个体的金黄色葡萄球菌菌株的不同预言基因谱
摘要金黄色葡萄球菌菌株与特应性皮炎(AD)表现出不同的关联,但是基于致病性的遗传决定因素尚未充分表征。为了揭示AD患者和健康个体(HE)的金黄色葡萄球菌菌株之间的遗传差异,我们开发并采用了随机的森林分类器来识别负责其表型变异的潜在标记基因。分类器能够有效地将菌株与AD和HE区分开。我们还发现了某些标记基因和噬菌体功能之间的牢固联系,噬菌体霍林出现为最关键的分化因子。对金黄色葡萄球菌基因含量的进一步研究强调了预言在推动与AD菌株之间分化的遗传多样性和功能意义。HE组表现出更大的基因含量多样性,在很大程度上受其预言的影响。虽然AD和他普遍容纳预言的菌株,但HE组中的菌株在应变水平上却明显更高。此外,尽管HE组中的预言表现出更高的差异功能的富集,但AD组在其预言中表现出显着的毒力因子的富集,强调了预言对AD相关菌株的发病机理的重要贡献。总体而言,预言显着塑造了金黄色葡萄球菌菌株的遗传和功能谱,阐明了其致病潜力,并阐明了AD和HE环境的表型变化背后的机制。
金黄色葡萄球菌/皮肤薄膜的葡萄球菌通过石榴果皮提取物平衡:一种生态可持续的方法
皮肤微生物群的不平衡的特征是相位微生物的病原体数量增加。从皮肤菌群收集开始,这项工作的目的是评估石榴(Punica Granatum L.)果皮提取物(PPE)在恢复皮肤微生物群在葡萄球菌spp上作用的可能作用。PPE,并分析植物化学组成和抗菌活性。对PPE抗菌作用进行了针对GR +,GR-细菌和酵母参考菌株的评估,并针对主要皮肤微生物群测试了最有效的提取物。PPE显示出最佳的抗菌作用,麦克风范围为1至128 mg/ml;主要的活性化合物是儿茶素,槲皮素,香草酸和长石酸。对s的DME抗粘附效应中的PPE进行了检查。epider- midis and s。金黄色葡萄球菌和双种物种生物膜通过生物量定量和CFU/ML确定形成。通过使用体内模型中的梅洛尼亚菌(Galleria Mellonella lar-vae)评估提取物毒性。提取物在4和8 mg/ml的s中表现出显着的抗粘附活性,具有特定于S的特定物种作用。表皮和s。金黄色葡萄球菌和双物种生物膜。ppe可以代表可持抗性的无毒层,以特定于物种特异性的方式影响葡萄球菌皮肤定植。这项工作的创新是用食物浪费以平衡皮肤微生物群的。
开发靶向PBP2A的非β-内酰胺共价抑制剂在耐甲氧西林的金黄色葡萄球菌
耐甲氧西林金黄色葡萄球菌(MRSA)是一种革兰氏阳性的细菌病原体,继续对我们社会中当前的公共卫生系统构成严重威胁。MRSA中对β-内酰胺抗生素的高度抗性归因于青霉素结合蛋白2a(PBP2A)的表达,这会催化细胞壁交联。根据大量研究报告,已知PBP2A蛋白的活性受到与细胞壁交联的活性位点不同的变构位点的调节。在这里,我们对包含1,3,4-氧化唑核的113种化合物进行了筛选,以设计针对PBP2A变构位点的新共价抑制剂并建立其结构活性关系。在初始筛选中鉴定出的磺酰氧化二唑化合物的立体选择性合成导致细胞抑制活性的最大增强。基于基于PEG的药膏的磺酰基黄烷二唑的化合物,对人细胞的毒性测试低(CC 50:>78μm),不仅在小鼠皮肤伤口感染模型中,而且还针对抗氧蛋白抗抗性临床分离型MRSA(IC 50ous)(IC 50oubious),表现出了有效的抗菌作用。此外,利用LC-MS/MS和硅内方法的其他研究清楚地支持了通过亲核芳香族反应(S NAR)反应(S NAR)的变构位点共价结合机制,以及与PBP2A主要活性位点关闭的关联。
VRSA 疾病计划 - 犹他州流行病学
临床描述金黄色葡萄球菌可引起多种皮肤和软组织感染,以及菌血症、心内膜炎和中毒性休克综合征等侵袭性疾病。葡萄球菌可产生多种细胞外致病因子,导致许多疾病表现,包括毒素、白细胞毒素(破坏白细胞的能力)和溶血素(破坏红细胞的能力),以及在导管和端口上产生生物膜和荚膜的能力(帮助细菌逃避免疫系统)。病原体金黄色葡萄球菌是一种革兰氏阳性球菌。VRSA 和 VISA 是对一种称为万古霉素的糖肽类抗生素产生获得性耐药性(完全或中度耐药)的细菌。鉴别诊断万古霉素和替考拉宁是糖肽类抗生素。如果金黄色葡萄球菌对这两种抗生素都有耐药性,则称为糖肽耐药/中等金黄色葡萄球菌或 GRSA/GISA。实验室鉴定以下算法演示了适当的实验室鉴定方案。更多信息可参见:http://www.cdc.gov/HAI/organisms/visa_vrsa/visa_vrsa.html。
探索氨基酸和肽转运蛋白作为葡萄球菌中毒力和抗生素耐药性的治疗靶标
氨基酸对于维持细胞完整性和代谢稳态至关重要。除了蛋白质合成之外,氨基酸也是核苷酸,脂质和细胞壁成分生物合成的前体。s。金黄色葡萄球菌可以合成许多此类氨基酸,但通常会从外部环境中转移到细胞中[2]。有限的葡萄糖可用性(例如,脓肿中)代表了一个环境,其中肽或氨基酸的分解代谢对金黄色葡萄球菌的生长很重要[3]。生物启动分析揭示了启用s的几种途径。金黄色葡萄球菌可分解多种氨基酸,进而可以生成关键的中央代谢中间体,例如丙酮酸,草乙酸和2-氧化甲酸酯。反映了氨基酸在代谢中的重要性,s。金黄色葡萄球菌具有多种寡肽磁盘,游离氨基酸转运蛋白和蛋白酶以降解宿主蛋白。分析64 s。金黄色葡萄球菌菌株表明,氨基酸代谢基因与pangenome分别相关[4],表明靶向与核心氨基酸代谢相关的转运蛋白可能具有针对多样化S的更广泛的治疗潜力。金黄色葡萄球菌分离。氨基酸,肽,渗透剂和核苷摄取系统的多样性和冗余也带来了重大挑战。在USA300_FPR3757基因组中至少有292个基因,预计将编码膜转运蛋白,其中120个似乎与氨基酸,渗透剂或核苷转运有关。从历史上看,细菌膜转运的研究生物信息学工具通常有助于识别和预测固定转运蛋白的功能,但是需要实验性工作来验证按测量值运输的底物及其生理角色。