机构名称:
¥ 1.0
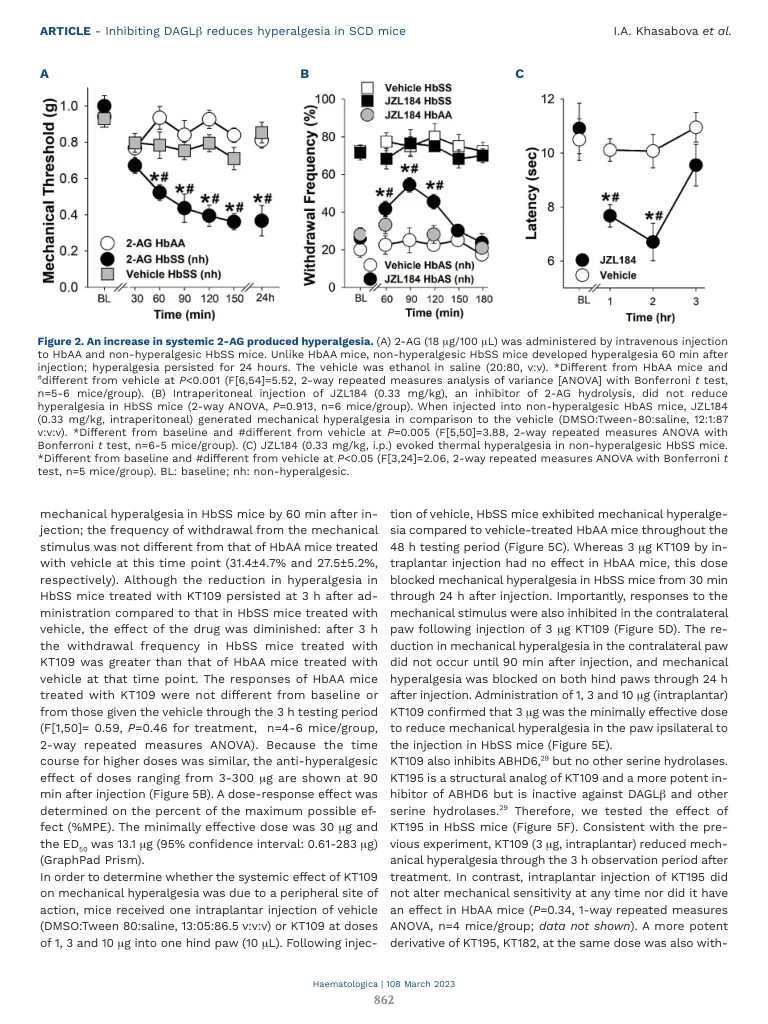
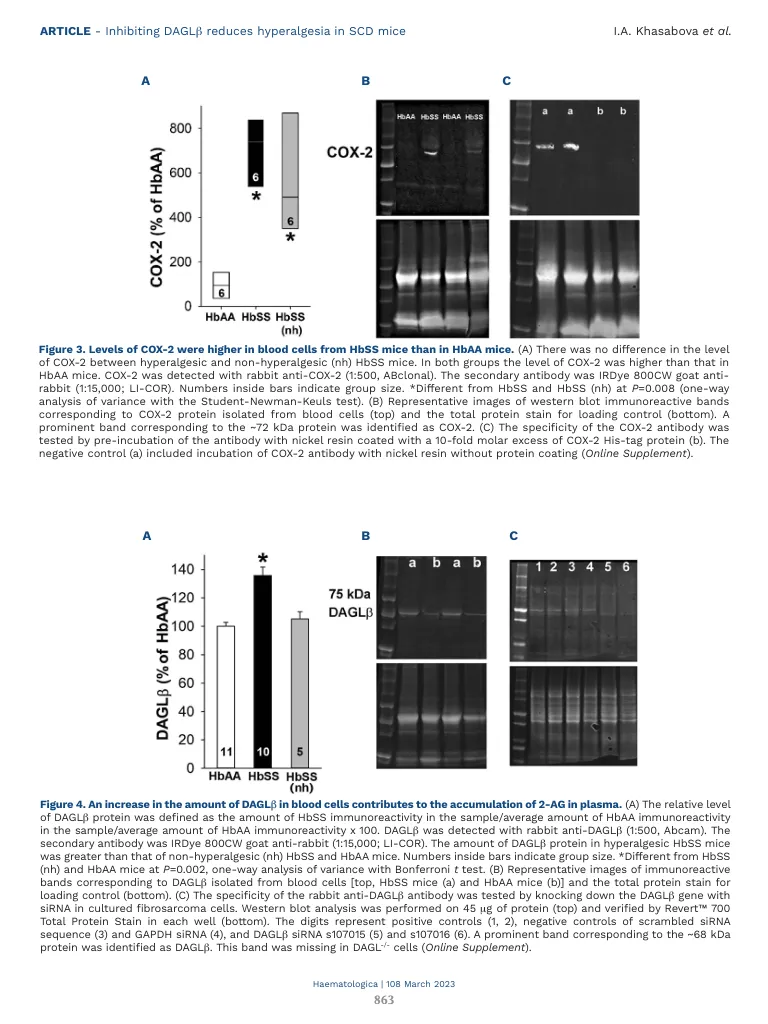
镰状细胞疾病(SCD)是最常见的遗传疾病。疼痛是SCD的关键发病率,而阿片类药物是主要治疗方法,但它们的副作用强调了对新的镇痛方法的需求。人性化的转基因小鼠模型在理解SCD的病理学和疼痛机制方面具有启发性。纯合(HBSS)Berkley小鼠表达> 99%的人类镰状血红蛋白和包括Hypergergesia在内的临床SCD的几种特征。以前,我们报道了内源性大麻素2-芳基烯丙基甘油(2-AG)是促伤害性介体Prostaglandin e2------------------酯(PGE 2 -G)的前体,这会导致SCD中的女超敏。现在,我们证明了2-AG在镰状小鼠中2-AG的因果作用。HBSS小鼠中的痛觉过敏与血浆中2-AG水平升高相关,其合成酶二酰基甘油脂肪酶β(DAGLβ)在血细胞中的合成,PGE 2和PGE 2和PGE 2 -g,pGE 2 -g,副造影剂的水平升高。在非疗法HBSS小鼠中,单次静脉注射2AG产生了痛觉过敏,但在对照(HBAA)中不表达正常的人HBA。JZL184,一种2AG水解的抑制剂,也会在非高温HBSS或半合子(HBAS)小鼠中产生痛觉过敏,但并未在高过时的HBSS小鼠中影响痛觉过敏。daglβ的抑制剂KT109的全身性和内倾剂给药减少了HBSS小鼠的机械和热痛觉过敏。Hypergeria的降低伴随着2 AG,PGE 2和PGE 2 -G的降低。这些结果表明,通过靶向daglβ来维持血液中2-AG的生理水平可能是治疗SCD疼痛的新颖有效的方法。
抑制DAGLβ作为镰状疼痛的治疗靶标...