机构名称:
¥ 1.0
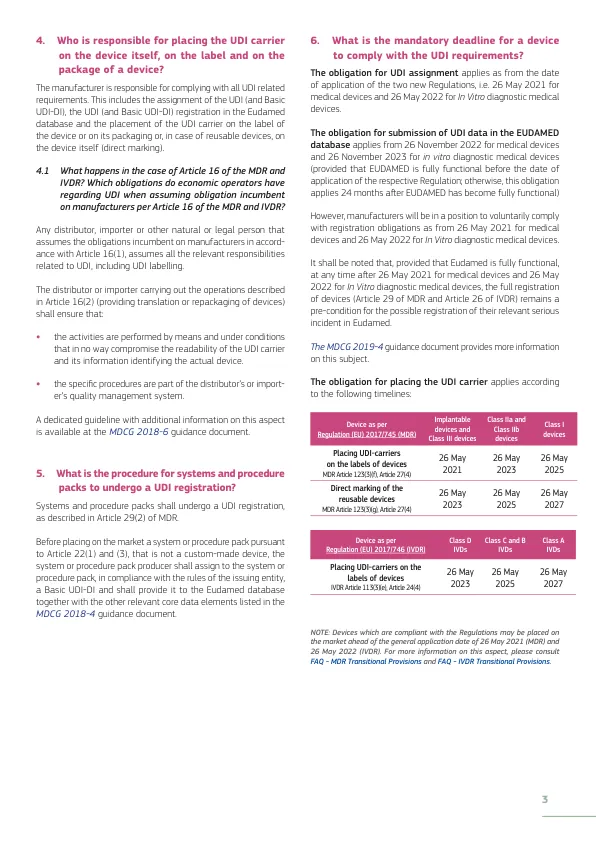
根据新规定,任何制造商在将器械投放市场之前,都应为器械及所有更高级别的包装分配唯一的 UDI,定制医疗器械和性能研究/调查器械除外。UDI 载体应贴在器械标签上和所有更高级别的包装上,如果是可重复使用的器械,则应贴在器械本身上(直接标记)。制造商还应确保根据 MDR 第 27(3) 条和 IVDR 第 24(3) 条的要求,将相关法规附件 VI 第 B 部分和 A 部分第 2 节中提及的与相关器械相关的信息正确提交给欧洲医疗器械数据库 (Eudamed)。制造商还应为其器械维护唯一的 UDI。
唯一器械标识 (UDI) 系统