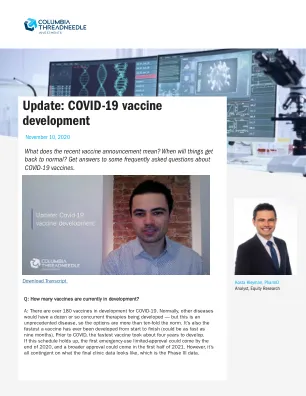
问:在III期临床试验之后,我们可以期待什么?问:在III期临床试验之后,我们可以期待什么?如果来自一种或多种疫苗的III期数据是阳性的,这表明其中一种疫苗有效,则制造商将与FDA合作,将其所有数据提交接受疫苗的人类患者,以及随附的动物和制造数据。目的是让FDA确认结果并更好地了解疫苗是否达到降低患病风险的最低阈值。此外,FDA还必须确保疫苗安全并与已批准其他病毒的其他疫苗保持一致。在开发中使用多种疫苗使用不同的技术并由不同的公司开发的伟大之处在于,它增加了我们至少将一种疫苗推向市场的机会。问:辉瑞/Biontech疫苗公告是什么意思? 问:辉瑞/Biontech疫苗公告是什么意思? A:辉瑞和Biontech宣布其疫苗有效90%以上,这意味着接受治疗疫苗的人的疫苗有疫苗的疫苗,获得了COVID-19的可能性降低了90%。 这比许多分析师所期望的要领先。 作为比较的基础,流感疫苗的有效性仅约40%至50%。 非常积极的数据意味着我们可能会更快地将疫苗可供选择,只要安全数据看起来不错,我们也可能会看到更多的人接种疫苗。 我们仍然需要查看完整的数据才能知道看到了哪些副作用。问:辉瑞/Biontech疫苗公告是什么意思?问:辉瑞/Biontech疫苗公告是什么意思? A:辉瑞和Biontech宣布其疫苗有效90%以上,这意味着接受治疗疫苗的人的疫苗有疫苗的疫苗,获得了COVID-19的可能性降低了90%。 这比许多分析师所期望的要领先。 作为比较的基础,流感疫苗的有效性仅约40%至50%。 非常积极的数据意味着我们可能会更快地将疫苗可供选择,只要安全数据看起来不错,我们也可能会看到更多的人接种疫苗。 我们仍然需要查看完整的数据才能知道看到了哪些副作用。问:辉瑞/Biontech疫苗公告是什么意思?A:辉瑞和Biontech宣布其疫苗有效90%以上,这意味着接受治疗疫苗的人的疫苗有疫苗的疫苗,获得了COVID-19的可能性降低了90%。这比许多分析师所期望的要领先。作为比较的基础,流感疫苗的有效性仅约40%至50%。非常积极的数据意味着我们可能会更快地将疫苗可供选择,只要安全数据看起来不错,我们也可能会看到更多的人接种疫苗。我们仍然需要查看完整的数据才能知道看到了哪些副作用。问:将III阶段数据提交给FDA之后需要多长时间? 问:将III阶段数据提交给FDA之后需要多长时间? 通常,FDA承诺在提交数据提交后的八个月后在短时间内返回其结果。 但是,对于Covid-19,由于病毒的影响在全球范围内,我们正在研究加速时间表。 因此,我们可以期望从第三阶段数据读取到紧急使用授权(EUA)的一个月周转时间。 EUA仅适用于有限的个人:医护人员,一线工人和具有免疫功能障碍条件的人。 这些人有获得COVID-19的风险更高,因此,对于他们来说,可能比更广泛的人口更快地获取疫苗是值得的。 风险降低的人可以等待支撑疫苗安全有效的其他证据。 更广泛的人口应早在2021年上半年接受疫苗。 从现在到那个时候,我们将能够收集更多的安全信息,以确切知道哪些患者应该根据数据收到疫苗。 问:每个人都会有足够的疫苗供应吗? 问:每个人都会有足够的疫苗供应吗? a:疫苗被监管机构批准后,供应问题。 开发疫苗的大多数药品公司都希望到2021年底能够生产约十亿剂。 和大多数国家已经与领先的开发商签约为其公民供应。问:将III阶段数据提交给FDA之后需要多长时间?问:将III阶段数据提交给FDA之后需要多长时间? 通常,FDA承诺在提交数据提交后的八个月后在短时间内返回其结果。 但是,对于Covid-19,由于病毒的影响在全球范围内,我们正在研究加速时间表。 因此,我们可以期望从第三阶段数据读取到紧急使用授权(EUA)的一个月周转时间。 EUA仅适用于有限的个人:医护人员,一线工人和具有免疫功能障碍条件的人。 这些人有获得COVID-19的风险更高,因此,对于他们来说,可能比更广泛的人口更快地获取疫苗是值得的。 风险降低的人可以等待支撑疫苗安全有效的其他证据。 更广泛的人口应早在2021年上半年接受疫苗。 从现在到那个时候,我们将能够收集更多的安全信息,以确切知道哪些患者应该根据数据收到疫苗。 问:每个人都会有足够的疫苗供应吗? 问:每个人都会有足够的疫苗供应吗? a:疫苗被监管机构批准后,供应问题。 开发疫苗的大多数药品公司都希望到2021年底能够生产约十亿剂。 和大多数国家已经与领先的开发商签约为其公民供应。问:将III阶段数据提交给FDA之后需要多长时间?通常,FDA承诺在提交数据提交后的八个月后在短时间内返回其结果。但是,对于Covid-19,由于病毒的影响在全球范围内,我们正在研究加速时间表。因此,我们可以期望从第三阶段数据读取到紧急使用授权(EUA)的一个月周转时间。EUA仅适用于有限的个人:医护人员,一线工人和具有免疫功能障碍条件的人。 这些人有获得COVID-19的风险更高,因此,对于他们来说,可能比更广泛的人口更快地获取疫苗是值得的。 风险降低的人可以等待支撑疫苗安全有效的其他证据。 更广泛的人口应早在2021年上半年接受疫苗。 从现在到那个时候,我们将能够收集更多的安全信息,以确切知道哪些患者应该根据数据收到疫苗。 问:每个人都会有足够的疫苗供应吗? 问:每个人都会有足够的疫苗供应吗? a:疫苗被监管机构批准后,供应问题。 开发疫苗的大多数药品公司都希望到2021年底能够生产约十亿剂。 和大多数国家已经与领先的开发商签约为其公民供应。EUA仅适用于有限的个人:医护人员,一线工人和具有免疫功能障碍条件的人。这些人有获得COVID-19的风险更高,因此,对于他们来说,可能比更广泛的人口更快地获取疫苗是值得的。风险降低的人可以等待支撑疫苗安全有效的其他证据。更广泛的人口应早在2021年上半年接受疫苗。从现在到那个时候,我们将能够收集更多的安全信息,以确切知道哪些患者应该根据数据收到疫苗。问:每个人都会有足够的疫苗供应吗?问:每个人都会有足够的疫苗供应吗?a:疫苗被监管机构批准后,供应问题。开发疫苗的大多数药品公司都希望到2021年底能够生产约十亿剂。和大多数国家已经与领先的开发商签约为其公民供应。假设有多种疫苗被批准,大多数国家 /地区应该有足够的供应量 - 在2021年未接种疫苗的人应该不久之后就可以接种疫苗。
更新:COVID-19疫苗开发
主要关键词