机构名称:
¥ 1.0
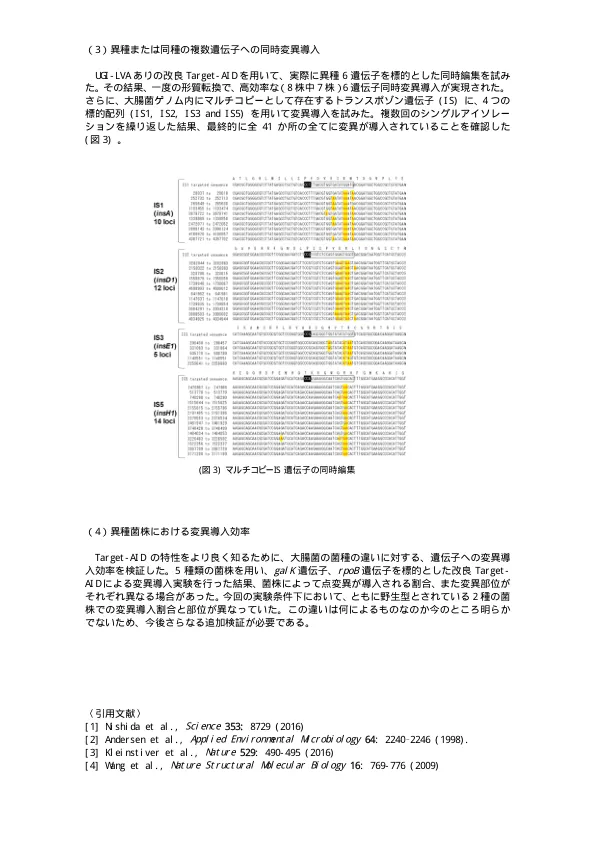
因此,我们旨在通过反复进行目标AID的基本构建以及对反馈的评估和验证,以建立高度的技术。 (1)基本技术的构建:首先创建超级目标AID,为了使基因组编辑更有效,我们将创建一个改进的功能目标AID(超级目标AID)。研究主要考虑质粒方面的变化。我们旨在通过使用没有复制能力的瞬态质粒来控制温度敏感启动子和组成启动子的DCAS9和CRISPR-GRNA,使用快速降解酶(LVATAG)[参考2],以及使用抑制DNA修复机制(UGIS)的系统。接下来,我们还将考虑修改酶本身。我们还考虑使用反遗传方法的改进,例如减少CAS9非特异性结合的突变[参考3],增加辅助酶活性的突变[参考4]以及对融合酶的接头长度的修改。 (2)评估基础替代效率:基因组编辑中靶点效应的验证,关键点是如何抑制与目标序列不同的位点的意外诱变,以及如何验证这一点。意外突变包括通过类似于目标序列的靶向序列引入的突变,以及完全独立于序列的非特异性突变。为了验证脱靶,使用破坏RPOB基因的利福平抗药性菌株进行评估。在改进目标基因,培养条件和目标AID的编辑方法的同时,进行了非目标评估,并最终进行了大肠杆菌的整个基因组序列以验证测试。
17K17879研究结果报告