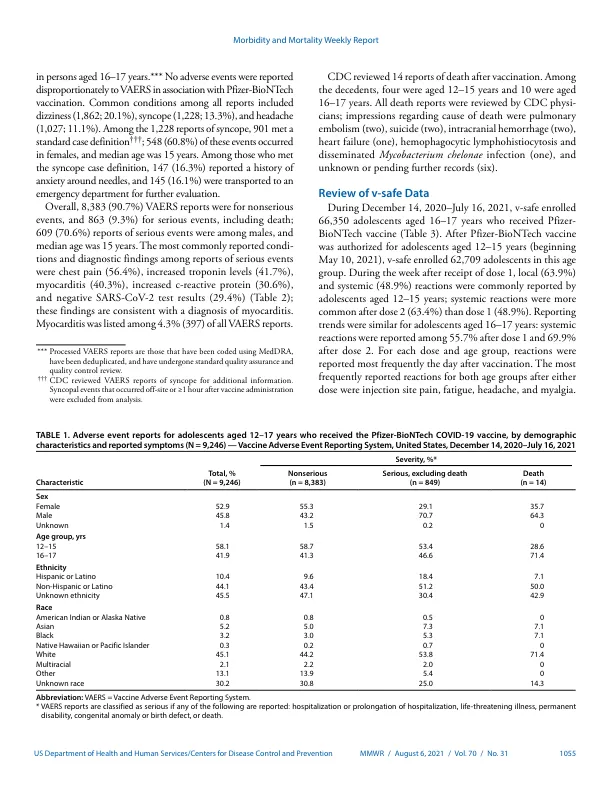
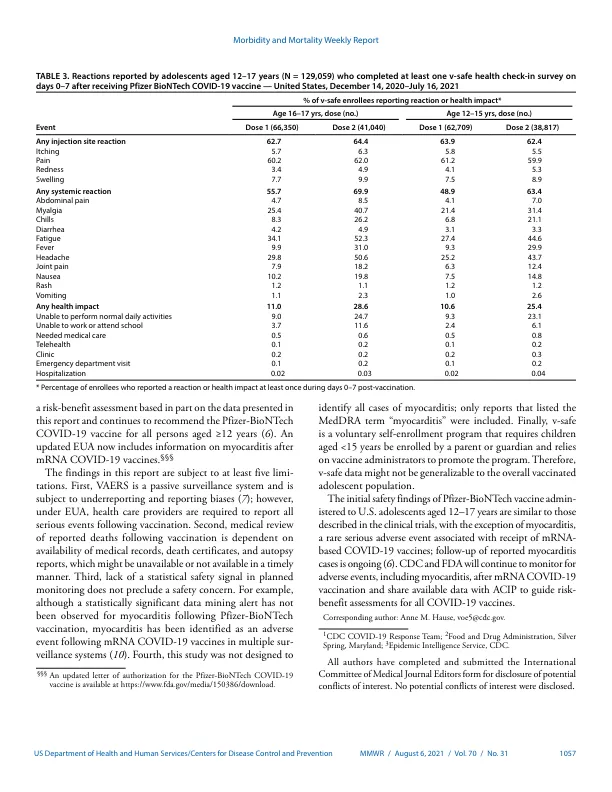
截至2021年7月30日,在美国授权使用的三种Covid-19疫苗中,只有Pfizer-Biontech Bnt162b2 mRNA Covid-19疫苗被授权为12-17岁的Ado lescents授权。食品药品监督管理局(FDA)发布了辉瑞式授权(EUA),用于辉瑞-biontech疫苗,用于2020年12月11日(1)的年龄≥16岁的人(1);根据3阶段临床试验的结果,EUA扩展到了2021年5月10日(2)的青少年(3)。从2021年6月开始,在收到辉瑞 - 苯甲酸疫苗疫苗后,心肌炎和心肌炎病例(以下是心肌炎)开始报道,主要是在接受第二剂剂量后的年轻男性中(4,5)。2021年6月23日,疾病预防控制中心的免疫实践咨询委员会(ACIP)审查了可用的数据,并认为COVID-19-COVID-19对个人的疫苗接种的好处和人口的益处超过了心肌炎的风险,并建议在年龄≥12岁的人中继续使用疫苗(6)。为了进一步表征疫苗的安全性,收到辉瑞生命事件报告系统(VAERS)(VAERS)收到辉瑞生物-biontech疫苗后的不良事件以及在V-SAFE(基于智能手机的安全性安全系统)中报告的不良事件和健康影响评估在12月14日,在12月14日,2020年12月16日,在20至1620年的2月16日, 截至2021年7月16日,大约890万年龄在12-17岁的美国青少年接受了辉瑞-biontech疫苗。 大约有129,000名在V-SAFE 的12-17岁的美国青少年截至2021年7月16日,大约890万年龄在12-17岁的美国青少年接受了辉瑞-biontech疫苗。大约有129,000名在V-SAFE*该年龄段的辉瑞-biontech疫苗接种后收到了9,246份报告;其中90.7%用于不遗忘的不良事件,9.3%用于严重的不良事件,包括心肌炎(4.3%)。
COVID-19岁的青少年疫苗安全12-17岁
主要关键词