XiaoMi-AI文件搜索系统
World File Search System头部和颈部paragangliomas患者的主要敏感性基因的突变频率
头部和颈部paragangliomas(HNPGL)是罕见的神经内分泌肿瘤,具有高度的遗传力,并且主要与十个基因的突变相关,例如SDHX,SDHAF2,SDHAF2,VHL,VHL,RET,RET,RET,NF1,NF1,NF1,TMEM127,MAX,MAX,FH,MEN2,MEN2,MEN2,MEN2和SLC25A11。阐明突变患病率对于基因检测的发展至关重要。在这项研究中,使用整个外显子组测序中,我们在102名HNPGL(82个颈动脉和23个迷走神经paragangliomas)的俄罗斯患者中鉴定了主要易感性基因中的致病/可能致病变异。在43%(44/102)的患者中检测到致病性/可能的致病变异。我们确定了测试基因的以下变体分布:SDHA(1%),SDHB(10%),SDHC(5%),SDHD(24.5%)和RET(5%)。SDHD变体。因此,在HNPGLS患者中,最常见的基因是SDHD,其次是SDHB,SDHC,RET和SDHA。
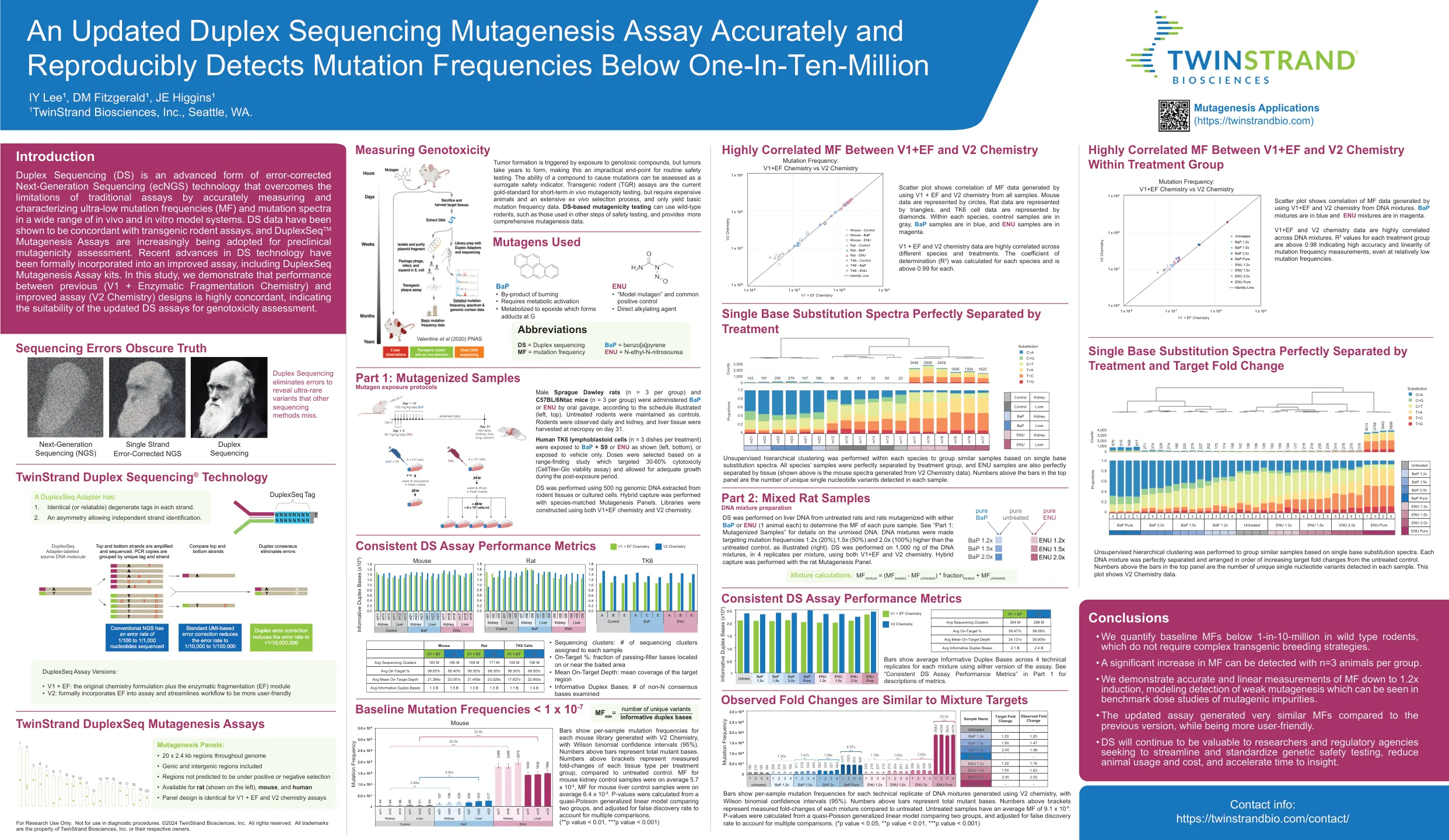
准确的更新的双链测序诱变测定法,可重复检测到低于一十分三百万的突变频率
条显示了用V2化学产生的每个小鼠文库的每样本突变频率,威尔逊二项式置信区间(95%)。条上方的数字代表总突变碱基。与未处理的对照相比,支架上方上方的数字代表每个治疗组的每种组织类型的倍数变化。MF平均为5.7 x 10 -8,小鼠肝对对照样品的MF平均为6.4 x 10 -8。p值是从比较两组的准散孔概括的线性模型中计算得出的,并根据错误的发现率进行了调整以考虑多个比较。(** p值<0.01,*** p值<0.001)仅用于研究使用。不适用于诊断程序。©2024 Twinstrand Biosciences,Inc。保留所有权利。所有商标都是Twinstrand Biosciences,Inc。或其各自所有者的财产。
文档3-3
根据经合组织的测试指南和符合GLP的需求,在体内对转基因大鼠的诱变性研究中测试了AMES测试阳性的N-硝基氨基三西汀。结果表明,N-亚硝基 - 阿诺西汀在十二指肠组织中以100 mg/kg/day的剂量和肝脏水平≥30mg/kg/kg/天的剂量水平和肝脏中的CII基因上的突变频率增加。在肝脏的较低剂量水平为0.1、0.537和5 mg/kg/天的突变频率不会增加,因此表现出“阈值”剂量反应关系。 体内诱变性的无效级别(NOEL)为5 mg/kg/day,基准剂量较低的置信度(BMDL;基于验证良好的基准剂量数据分析)为4.4 mg/kg/kg/kg。 使用ICH M7R2指南中的原理得出了4400 ng/d的可接受摄入量,其中保守使用BMDL值代替TD 50值,该值与50%肿瘤发生率相关的剂量(ICH 2023;注意4)。突变频率不会增加,因此表现出“阈值”剂量反应关系。体内诱变性的无效级别(NOEL)为5 mg/kg/day,基准剂量较低的置信度(BMDL;基于验证良好的基准剂量数据分析)为4.4 mg/kg/kg/kg。使用ICH M7R2指南中的原理得出了4400 ng/d的可接受摄入量,其中保守使用BMDL值代替TD 50值,该值与50%肿瘤发生率相关的剂量(ICH 2023;注意4)。
针对同源重组成瘾肿瘤
与癌症易感性和肿瘤发生相关的 DDR 基因的发现迫使 NGS 面板扩展个性化方法,以超越 BRCAness(即 BRCA1/2 基因)的范畴。然而,仅仅试图扩展 DDR 基因面板也有局限性。首先,尚不清楚低频突变的 DDR 基因(甚至是变体)是否真的是肿瘤发生的驱动改变。不幸的是,在许多情况下,包括 BRCA1/2 突变肿瘤在内,在特定肿瘤类型中发现的突变频率可能与更常见的癌症驱动基因(例如 Kras 或 TP53 )相比非常低,因此很难判断这些事件是否在给定的患者群中经常被选择。根据传统癌症遗传学的中心法则,某种肿瘤类型的突变频率必须高于健康对照群体的预期 (7)。其他复杂层面包括这些 DDR 相关基因是否具有与 BRCA1/2 等已建立的 DDR 基因相同的致命弱点(也称为合成致死性),以及这些基因是否符合经典的肿瘤抑制规则,即需要在肿瘤中丢失第二个等位基因(例如杂合性缺失,LOH)(7)。因此,在许多 DDR 基因中,尚不清楚这些 DDR 缺陷基因是否具有预测治疗价值。基于这些问题,许多研究人员试图设计检测分子特征的检测方法,以识别具有缺陷 DDR 通路的肿瘤(即 HRD,见下文)。
基于患者细胞的药物基因组学评估,揭示晚期肺癌的潜在耐药机制和新疗法
实体肿瘤的表达谱。由于 LUAD 在我们的队列中占主导地位(> 80%),我们将 PDC 基因表达谱与 TCGA-LUAD 数据集(n = 230)进行了比较。正如预期的那样,PDC 基因组图谱与肿瘤样本相似,并与正常邻近组织区分开来(图 1B)[36]。PDC 和 TCGA 样本中的组成性体细胞基因突变相似。TP53、RB1 和 BRAF 突变的复发在 PDC 和 TCGA 样本中都得到了高度保留。PDC 中的 EGFR 突变频率较高,而 KRAS、KEAP1 和 STK11 突变的复发低于 TCGA 样本(图 1B)。因此,在 PDC 模型中经常观察到 TP53(49%)、EGFR(31%)和 RB1(8%)的体细胞突变(图 1C)。此外,MET (10%)、CDK4 (6%)、
自愿公告-临床批准...
表皮生长因子受体(EGFR)是突变频率最高的基因之一,也是非小细胞肺癌最重要的驱动基因,其中东亚人群突变率高达40%-50%,西方人群突变率高达10%-20%1。TQB3002通过竞争性结合胞内酪氨酸激酶结合域的ATP位点,抑制相关酪氨酸激酶的活性及胞内磷酸化过程,从而抑制EGFR下游信号传导,最终导致肿瘤细胞死亡。目前,第一、二、三代EGFR抑制剂被广泛应用于临床,每一代药物的研发都是为了解决上一代药物的耐药性2。基于此,本集团开发了第四代口服小分子EGFR抑制剂TQB3002。
工程性动物模型的多余jak2 v617f突变体等位基因负担
多性疾病Vera(PV)是一种慢性骨髓增生性新血浆(MPN),其特征是红细胞过量。超过95%的PV患者疾病是由JAK2 V617F突变驱动的。虽然JAK2 V617F突变小鼠模型为PV生物学提供了机械见解,但这些模型中的大多数呈现出比在PV患者中发现的JAK2 V617F的变体等位基因频率(VAF)高得多的突变细胞负担。因此,当前的PV小鼠模型对PV DE Velopment的最早阶段的了解有限,包括疾病表现所需的最小突变细胞负担是什么。为了避免这些局限性,我们开发了一种使用CRISPR/CAS9同源指导修复(HDR)的PV的工程模型,以使JAK2 V6717F突变突变到人类CD34 +细胞的内源性基因座。Xenograftage靶向细胞进入NSGS小鼠,在体内概括了人类PV病理。我们使用此工具来解决两个问题:(i)生成PV病理所需的最小突变体VAF是什么,并且(ii)起源细胞的发育环境会影响MPN的疾病轨迹。该模型提供了一种有价值的临床前工具,可以在体内测试新的PV疗法,并在主要患者样品受到限制或不可用时研究PV的开发和进展。脊髓增生性肿瘤(MPN)是由造血干细胞和祖细胞(HSPC)中获得的体细胞突变驱动的,其特征是一个或多个髓样谱系的异常增殖。JAK2 V617F突变是MPN的反复驱动器。1,2 MPN可以作为多性心血症垂直(PV;过量的红细胞),必需的血小板细胞(ET;多余的血小板)或骨髓纤维化(MF;骨髓纤维化)。3-5然而,JAK2 V617F突变细胞的负担在患者中差异很大,并且可以诱导VAF非常低的临床表型。6,7在PV中,超过95%的患者将JAK2 V617F作为驱动致病性突变,但在某些患者中,突变负担可能低于3%VAF。 8尚不清楚这种低突变细胞负担如何产生MPN病理。 当前的JAK2 V617F小鼠建模策略利用复古病毒转导,9,10个转基因等位基因,11或遗传敲入(KI)模型。 12,13然而,这些模型中的大多数产生了高JAK2 V617F突变频率,这些突变频率不能准确反映PV患者的克隆轨迹。 为了超越小鼠模型的局限性,我们最近开发了从MPN患者移植CD34 +细胞的方法,以产生患者衍生的异种移植物(PDX)。 在MF的情况下,对患者衍生的CD34 +细胞的异型范围能够传播基因型,表型和关键患者病理,例如PDX中的网状纤维化。 14然而,尝试从PV患者产生PDX的尝试不太成功,植入率很差和可获得的CD34 +细胞数量有限6,7在PV中,超过95%的患者将JAK2 V617F作为驱动致病性突变,但在某些患者中,突变负担可能低于3%VAF。8尚不清楚这种低突变细胞负担如何产生MPN病理。当前的JAK2 V617F小鼠建模策略利用复古病毒转导,9,10个转基因等位基因,11或遗传敲入(KI)模型。12,13然而,这些模型中的大多数产生了高JAK2 V617F突变频率,这些突变频率不能准确反映PV患者的克隆轨迹。为了超越小鼠模型的局限性,我们最近开发了从MPN患者移植CD34 +细胞的方法,以产生患者衍生的异种移植物(PDX)。在MF的情况下,对患者衍生的CD34 +细胞的异型范围能够传播基因型,表型和关键患者病理,例如PDX中的网状纤维化。14然而,尝试从PV患者产生PDX的尝试不太成功,植入率很差和可获得的CD34 +细胞数量有限
plasmamatch:旨在评估
次要结果度量1。临床利益率和无进展生存率(PFS),定义为完全/部分反应或稳定疾病,由recist v1.1至少持续24周定义。PFS将从进入治疗队列的日期到第一次根据RECIST标准或死亡确认进行性疾病的日期。2。使用NCI CTCAE v4.0 3。响应持续时间是从第一个记录恢复完整 /部分响应(以第一个状态记录为准)到第一次复发或进行性疾病的第一个日期,从而衡量的持续时间。4。< /div>在CTDNA筛查中鉴定出的突变频率以及进入治疗成分的可靶向突变患者的比例5。ctDNA突变状态与进入治疗成分的患者的组织突变状态之间的一致性6。在第2-4天和队列B评估的队列中的药代动力学评估1-4天1
在前列腺癌中使用PARP抑制剂
结果:21例(75%)患者可检测到CtDNA突变。最常见的突变基因是Crebbb(54%,15/28),KMT2D(50%,14/28),STAT6(29%,8/28),Card11(18%,5/28)(18%,5/28),PCLO(14%,4/28),EP300(14%,4/28),11%,BCL2(11%,3/28) 3/28),突变频率> 10%。患有可检测的CTDNA突变的患者倾向于出现晚期Ann Arbor期(III-IV)(p = 0.009),高FLIPI风险(3-5)(p = 0.023)和严重的淋巴结受累(编号涉及区域≥5)(p = 0.02)。此外,我们发现,晚期Ann Arbor阶段,高危FLIPI,乳酸脱氢酶升高(LDH:0 - 248U/L)的患者中的平均VAF较高,晚期病理学级,骨髓受累(BMI)和淋巴结的参与。此外,KMT2D,EP300和STAT6突变与下PFS相关(P <0.05)。