XiaoMi-AI文件搜索系统
World File Search System抗体 - 药物结合物的抗体比(DAR)(ADC
为了确定T-DM1的DAR,使用Zenotof 7600系统进行了糖基化和去糖基化形式的完整质量测量。在高分辨率TOF MS光谱中观察到了两种形式的T-DM1的复杂电荷状态分布(图2A和2D)。来自生物制剂Explorer软件的完整蛋白反向溶液的结果表明,糖基化的T-DM1的复杂MS谱由不同的Glycoforms组成,这些糖基型(包括G0F,G1F和G2F)(与多达8个分子的有效载荷DM1(图2B和图2B和2B和2C)相结合。通过比较,去除N连接的糖基化导致了更简单的MS曲线(图2D – F),其中检测到携带8 dm1的脱脂化T-DM1。用<10 ppm的质量精度鉴定了两种形式的T-DM1形式,并通过Biologics Explorer软件自动集成。图3显示了T-DM1的糖基化和退化形式的DAR分布。在这两种情况下,主要的T-DM1物种的DAR值为2-4(图3)。
组蛋白 ADP 核糖基化促进 DNA 损伤中 PARP1 释放,从而增强对 PARP 抑制剂的耐药性
由于 PARP 抑制剂能够特异性地杀死无法通过同源重组修复 DNA 的肿瘤,因此聚(ADP - 核糖)聚合酶 1 (PARP1) 已成为癌症治疗的中心靶点。DNA 损伤后,PARP1 会迅速与 DNA 断裂结合并触发 ADP - 核糖基化信号。ADP - 核糖基化对于将各种因子募集到损伤部位以及及时将 PARP1 从 DNA 断裂中分离非常重要。事实上,在 PARP 抑制剂存在的情况下,PARP1 会被困在 DNA 断裂处,这是这些抑制剂细胞毒性的潜在机制。因此,任何影响捕获的细胞过程都被认为会影响 PARP 抑制剂的效率,可能导致接受这些药物治疗的患者产生获得性耐药性。DNA 损伤后有许多 ADP - 核糖基化靶点,包括 PARP1 本身以及组蛋白。虽然最近的研究报告称 PARP1 的自我修饰会促进其从 DNA 损伤中释放,但其他 ADP - 核糖基化蛋白对这一过程的潜在影响仍不清楚。本文,我们证明组蛋白 ADP - 核糖基化对于 PARP1 从损伤中及时消散也至关重要,从而导致细胞对 PARP 抑制剂产生耐药性。考虑到 ADP - 核糖基化与其他组蛋白标记之间的串扰,我们的研究结果为开发更有效的 PARP 抑制剂驱动的癌症疗法开辟了有趣的前景。
1 CRISPR屏幕和凝集素微阵列标识小说...
聚糖在细胞信号传导和功能中起关键作用。与蛋白质不同,聚糖结构不是从基因模板中,而是许多基因的一致活性,使它们在历史上挑战研究。在这里,我们提出了一种利用合并的CRISPR屏幕和凝集素微阵列来揭示和表征细胞表面糖基化调节剂的策略。我们应用了这种方法来研究高甘露糖糖的调节 - 所有天冬酰胺(n)连接 - 聚糖的起始结构。我们使用CRISPR屏幕揭示了控制高甘露糖表面水平的基因的扩展网络,然后是凝集素微阵列,以完全测量精选调节剂对全球糖基化的复杂作用。通过此,我们阐明了两个新型的高甘露糖调节剂-TM9SF3和CCC复合物如何通过调节高尔基形态和功能来控制复合物N-糖基化。值得注意的是,这种方法使我们能够深入审问高尔基功能,并揭示与高尔基形态的类似破坏可以导致巨大不同的糖基化结果。总的来说,这项工作展示了一种可系统地剖析糖基化的调节网络的可推广方法。
揭秘人类和病原体中的聚糖秘密
糖基化是将碳水化合物添加到蛋白质的过程,是一种基本的生物学过程,对人类健康和疾病具有深远的影响。这些聚糖修饰在许多细胞过程中发挥着关键作用,包括蛋白质折叠、细胞信号传导和免疫识别。它们的失调与各种疾病有关,包括癌症、传染病和自身免疫性疾病 ( 1 , 2 )。糖基化重要性的一个显著例子是在癌症免疫治疗领域。癌症治疗的有效性,尤其是抗 PD-L1 单克隆抗体(如阿替利珠单抗)等免疫疗法,会受到肿瘤细胞糖基化模式改变的显著影响 ( 3 , 4 )。这些改变可以保护肿瘤细胞免受免疫监视并抑制对免疫疗法的反应。例如,阿替利珠单抗因疗效有限而退出乳腺癌治疗,凸显了糖基化改变带来的挑战 (5)。在这种情况下,半乳糖凝集素家族蛋白质,特别是半乳糖凝集素 9,成为癌症进展和治疗耐药性的关键因素,强调了糖基化和免疫逃避之间的错综复杂的联系,其中半乳糖凝集素 9 是有效免疫疗法(包括阿替利珠单抗等治疗方法)的潜在障碍 (6,7)。认识到糖生物学在健康和疾病中的重要性日益增加,《免疫学前沿》发表了题为“糖生物学和糖基化:揭开人类和病原体中聚糖的奥秘”的研究课题。 “本研究主题的深刻文章深入探讨了复杂的聚糖世界,每篇文章都提供了关于糖生物学与治疗策略之间联系的独特视角:
组蛋白ADP-核糖化促进对PARP的抗性...
poly(ADP-核糖)聚合酶1(PARP1)由于PARP抑制剂特异性杀死通过同源重组而缺乏DNA修复的肿瘤的能力,因此已成为癌症疗法的核心靶标。在DNA损伤后,PARP1迅速与DNA断裂结合并触发ADP -Ribosylation信号传导。ADP-核糖基化对于募集各种因素到损害部位以及及时的DNA断裂中PARP1的分解很重要。的确,在存在PARP抑制剂的情况下,PARP1在DNA断裂处被困,这是这些抑制剂细胞毒素的基础机制。因此,任何影响捕获的细胞过程都被认为会影响PARP抑制剂效率,这可能会导致接受这些药物治疗的患者获得的耐药性。DNA损伤后有许多ADP-核糖基化靶标,包括PARP1本身以及组蛋白。最近的发现报道说,PARP1的自动修饰促进了其从DNA病变中释放,但其他ADP核糖基化蛋白对这一过程的潜在影响仍然未知。在这里,我们证明了组蛋白ADP - 核糖基化对于及时从病变中耗散PARP1的核糖基化也至关重要,从而有助于细胞对PARP抑制剂的耐药性。考虑ADP-核糖基化和其他组蛋白标记之间的串扰,我们的发现开辟了有趣的观点,可以开发出更有效的PARP抑制剂 - 驱动的癌症疗法。
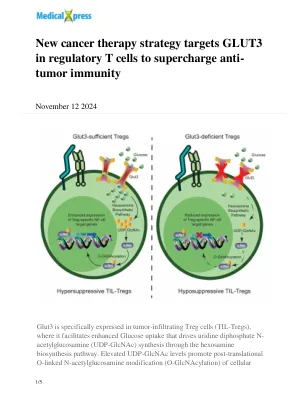
新的癌症治疗策略靶向调节性 T 细胞中的 GLUT3,以增强抗肿瘤免疫力
因素。这种修饰的一个关键目标是 NF-κB 转录因子的 c-Rel 亚基,其 O-GlcNAc 糖基化增强了 Treg 介导的免疫抑制所必需的 NF-κB 靶基因的表达。Treg 细胞中 Glut3 的缺失会降低 c-Rel O-GlcNAc 糖基化,从而减少免疫抑制并导致肿瘤生长减少。这些结果表明,开发针对 Treg 细胞中的 GLUT3 或 O-GlcNAc 糖基化途径的新药可以通过增强肿瘤微环境内的抗肿瘤免疫力来改善癌症患者的预后。图片来源:POSTECH
在筛查妊娠糖尿病时,糖基化的血红蛋白和空腹血糖可以取代葡萄糖挑战测试吗?
引言妊娠糖尿病是指在怀孕期间开始或首先被诊断出的任何程度的葡萄糖不耐症(1)。各种因素在妊娠糖尿病的发生率中起作用,包括诊断方法,种族,身体成分和月经开始时的年龄(2-4)。产妇年龄,超重或肥胖,种族,糖尿病家族史以及妊娠糖尿病史(GDM)是GDM的一些建议的危险因素。研究表明,在妊娠糖尿病中,脂质过氧化产物可能会增加,并且抗氧化剂酶的活性可能会降低,这可能会对母体和胎儿健康产生副作用。类似于2型糖尿病,GDM患者的血糖水平与脂质过氧化物浓度有关(5)。妊娠糖尿病的患病率最近在世界和伊朗(6-8)上升。这种常见的妊娠代谢疾病与许多母体和胎儿并发症有关(9,10)。妊娠糖尿病通常是无症状的,因此必须进行早期筛查,诊断和治疗(11)。理想的筛查测试应确定尽可能多的患者并分开患者(即
人参皂苷Rg3靶向PD-L1糖基化增强非小细胞肺癌的抗肿瘤免疫力
肺癌是全球最常见的癌症死亡原因,近 85% 的肺癌患者被确诊为非小细胞肺癌 (NSCLC),包括肺鳞状细胞癌和肺腺癌 (1,2)。肺癌是一种异质性疾病,具有复杂性,因此了解控制恶性进展的潜在机制对于获得更好的患者预后至关重要。NSCLC 中最常见的基因变异是克尔斯滕大鼠肉瘤 (KRAS) 和表皮生长因子受体 (EGFR) 基因,这些基因导致某些靶向抑制剂的耐药性 (3,4)。随着免疫疗法的发展,肺癌的治疗已从使用细胞毒疗法转变为一系列靶向疗法或免疫疗法,例如免疫检查点阻滞剂,如针对程序性细胞死亡蛋白 1 (PD-1) 或程序性死亡配体 1 (PD-L1) 的单克隆抗体药物。尼沃单抗、派姆单抗和阿特珠单抗已被用作临床治疗非小细胞肺癌的标准疗法( 5 – 7 )。尽管 PD-1/PD-L1 阻断疗法已显示出显著的临床益处,但由于 PD-L1 的表达和 T 细胞的浸润,反应率仍然不高( 8 )。PD-L1 是一种 33 kDa 跨膜蛋白,可与 PD-1 结合以抑制 T 细胞增殖和功能( 9 , 10 )。PD-L1 广泛表达于各种细胞类型,包括上皮细胞、内皮细胞、巨噬细胞和中性粒细胞。 PD-L1在NSCLC中的上调已得到充分研究,典型的PD-L1上调机制主要包括JAK-STAT-IRF1/TLR4/MAPK/PI3K信号通路转录上调PD-L1(10,11)。然而,最近的研究发现PD-L1还有多种翻译后修饰来调节其稳定性和功能,包括磷酸化、糖基化和多泛素化(12)。其中,PD-L1的糖基化对调节PD-L1的稳定性和PD-1的相互作用至关重要。PD-L1通常在N35、N192、N200和N219位点发生N连接糖基化(13)。一旦PD-L1被糖基化,它就会保护PD-L1免于降解,从而促进蛋白质的稳定性。事实上,非糖基化形式的PD-L1在细胞中会迅速发生蛋白质降解,这为临床管理提供了新的治疗策略。有趣的是,多项研究表明,PD-L1在肿瘤中高度糖基化,包括乳腺癌、肝细胞癌和黑色素瘤(13-16)。此外,Lee等人发现PD-L1的N连接糖基化阻碍了抗体的识别,从而部分解释了使用相同检查点阻断疗法时患者之间的不同结果(14)。因此,针对PD-L1的糖基化可能为基于免疫的抗肿瘤疗法提供新的见解。人参皂苷Rg3是人参皂苷中的活性成分,具有抗炎、抗肿瘤、抗感染等多种药理作用(17-19)。值得注意的是,Rg3已被公认为可以增强NSCLC的治疗,包括吉非替尼和埃克替尼(20)。Rg3还可以增强抗肿瘤免疫力,但其潜在机制尚不清楚。因此,我们假设Rg3可能对PD-L1糖基化的调节有影响。在本研究中,我们首先证实了NSCLC中PD-L1的糖基化,并评估了Rg3的作用。我们接下来揭示了EGFR-
演讲tm:揭示糖基化和免疫之间的甜蜜真理,每个细胞的每个细胞都覆盖在一个简单而综合的层
演讲tm:揭示糖基化和免疫之间的甜蜜真理,每个细胞的每个细胞都被称为聚糖的简单且复杂的碳水化合物覆盖(图1A),其中大多数通过称为糖基化的过程与蛋白质或脂质绑定。这些细胞表面蛋白的巨大结构多样性,进化和丰度取决于细胞类型和状态,因此被认为是反映不同细胞特征的“细胞特征”(1,2)。已知糖基化与免疫系统的不同方面有关,例如T细胞生物学,对于T细胞受体(TCR)的激活和功能至关重要。 TCR是T细胞表面上的蛋白质,识别并结合了异物物质,例如病原体或毒素,在激活T细胞中起关键作用。 糖基化可以通过改变其构象和稳定性以及调节其与其他蛋白质的相互作用来影响TCR的激活和功能(3)。 已知 t细胞代谢受聚糖调节。 经历克隆膨胀或增殖的 T细胞需要改变代谢,以承受通过有氧糖酵解和谷氨酰胺溶解的核苷酸,氨基酸和脂质合成的生物能量需求的增加(4)。 t细胞活化还上调了葡萄糖代谢的一个成分的己糖胺途径,以增加核苷酸糖供体底物UDP-GlcNAC。 此途径是N-糖基化,O-glcnacylation和糖氨基氨基聚糖的产生所必需的,这是功能性T细胞的要求(5)。糖基化与免疫系统的不同方面有关,例如T细胞生物学,对于T细胞受体(TCR)的激活和功能至关重要。TCR是T细胞表面上的蛋白质,识别并结合了异物物质,例如病原体或毒素,在激活T细胞中起关键作用。糖基化可以通过改变其构象和稳定性以及调节其与其他蛋白质的相互作用来影响TCR的激活和功能(3)。t细胞代谢受聚糖调节。T细胞需要改变代谢,以承受通过有氧糖酵解和谷氨酰胺溶解的核苷酸,氨基酸和脂质合成的生物能量需求的增加(4)。t细胞活化还上调了葡萄糖代谢的一个成分的己糖胺途径,以增加核苷酸糖供体底物UDP-GlcNAC。此途径是N-糖基化,O-glcnacylation和糖氨基氨基聚糖的产生所必需的,这是功能性T细胞的要求(5)。糖基化也是可能影响蛋白质的免疫原性的一个因素,该因素受到多种因素的影响,包括其结构和抗原决定因素的存在。将糖添加到蛋白质中时,可能会改变蛋白质的形状和电荷,从而可能影响免疫系统识别为异物。这可能会影响免疫系统对疫苗产生抗体和记忆细胞产生抗体和记忆细胞的能力,从而影响其有效性。T细胞表面蛋白糖基化的变化也会影响细胞因子的产生,信号分子有助于协调免疫反应(6)。免疫系统必须能够区分自我和非自我,以便正常运行。此过程失败会导致自身免疫性疾病的发展。这可能导致一系列症状,具体取决于被攻击的组织。自我抗原的糖基化模式的变化可以改变其抗原决定因素,这可能会导致自身免疫性,如鼠模型中所观察到的那样(7,8)。