XiaoMi-AI文件搜索系统
World File Search System指南:缺氧缺血性脑病 (HIE)
• 在当地可用资源、专业知识和实践范围内提供护理 • 支持消费者权利和知情决策,包括拒绝干预或持续管理的权利 • 在适合文化并能够进行舒适和保密的讨论的环境中,为消费者提供选择建议。这包括在必要时使用口译服务 • 确保在提供护理前获得知情同意 • 满足所有法律要求和专业标准 • 在提供护理时采取标准预防措施,并在必要时采取额外预防措施 • 按照强制性和当地要求记录所有护理 昆士兰卫生部在法律允许的最大范围内,对因使用本指南而产生的任何费用、损失、损害和成本不承担任何责任和义务(包括但不限于疏忽责任),包括本文件中包含或提及的材料以任何方式不准确、脱离上下文、不完整或不可用。推荐引用:昆士兰临床指南。缺氧缺血性脑病 (HIE)。指南编号:MN21.11-V12-R26。昆士兰州卫生部。2021 可从以下网址获取:http://www.health.qld.gov.au/qcg
下一代缺血性中风治疗平台
摘要 当前缺血性中风的治疗策略远未达到神经功能恢复的预期目标,亟待开发新的治疗方法。外泌体是一种天然的细胞来源的囊泡,在生理和病理条件下介导细胞间的信号转导,具有免疫原性低、稳定性好、输送效率高、能穿过血脑屏障等生理特性,有可能为缺血性中风的治疗带来新的突破。纳米技术的快速发展推动了工程化外泌体的应用,可有效提高靶向性、增强治疗效果、减少所需剂量。技术的进步也推动了外泌体的临床转化研究。本文概述了外泌体的治疗作用及其在当前缺血性中风治疗策略中的积极作用,包括其抗炎、抗凋亡、自噬调节、血管生成、神经生成和减少胶质瘢痕形成等作用。然而,值得注意的是,尽管外泌体具有巨大的治疗潜力,但仍然缺乏能够产生高纯度外泌体的标准化表征方法和有效的分离技术。未来的优化策略应优先考虑探索合适的分离技术和建立统一的工作流程,以有效利用外泌体进行缺血性中风的诊断或治疗应用。最终,我们的综述旨在总结我们对基于外泌体的缺血性中风治疗前景的理解,并为开发基于外泌体的疗法提供创新思路。关键词:血脑屏障;电针;工程;运动;外泌体;缺血性中风;间充质干细胞;小胶质细胞;神经保护;支架
缺氧缺血性脑病(HIE)
缺氧缺血性脑病(HIE)具有高死亡或残疾风险。每年,全球1500万人中风,大约33%的病例导致死亡,另有33%导致永久残疾。尽管有所有降低中风的发病率和死亡率的作用,但中风的绝对数量仍在增加。与案件增加有关的最重要因素之一似乎是在过去20年中观察到的预期寿命较长。中风的发生率在65岁以上的患者中显着增加(1)。全球疾病负担(GBD)研究表明,在30年(1990- 2019年)中,中风的绝对数量增加了70%。在全球范围内,残疾调整的终身年份(达利人)的普遍病例增加了119%,每年死亡人数为146%(2)。
谷氨酸作用于酸性离子通道,导致缺血性脑损伤
谷氨酸传统上被视为第一个激活NMDAR(N-甲基-D-天冬氨酸受体)依赖性细胞死亡途径1,2中的细胞死亡途径,但使用NMDAR拮抗剂进行了不成功的临床试验,暗示了其他机制3-7的参与。在这里,我们表明谷氨酸及其结构类似物,包括NMDAR拮抗剂L-AP5(也称为APV),通过与酸中毒诱导的中风中神经毒性相关的酸性离子通道(ASICS)介导的稳健性电流4。谷氨酸增加了ASIC对质子的亲和力及其开放概率,从而在体外和体内模型中加剧了缺血性神经毒性。定向诱变,基于结构的建模和功能测定法显示ASIC1A外细胞外结构域中的真正的谷氨酸结合腔。计算药物筛选确定了一个小分子LK-2,该分子与该空腔结合并废除了ASIC电流的谷氨酸依赖性增强,但避免了NMDARS。lk-2减少了缺血性中风的小鼠模型中的梗塞体积并改善了感觉运动恢复,让人联想到在ASIC1A敲除或其他阳离子通道4-7的小鼠中看到的。我们得出的结论是,谷氨酸是ASIC的阳性变构调节剂,以加剧神经毒性,并优先针对NMDARS上的ASIC上的谷氨酸结合位点靶向,以开发NMDAR Antagonist的精神病性副作用,以开发中风治疗。
含线粒体的小鼠与人脑内皮细胞的细胞外囊泡用于缺血性中风疗法
*通讯作者:Devika S Manickam 600 Forbes Avenue,453 Mellon Hall,匹兹堡,宾夕法尼亚州15282。电子邮件:soundaramanickd@duq.edu x/twitter:@manickam_lab电话:+1(412)396-4722
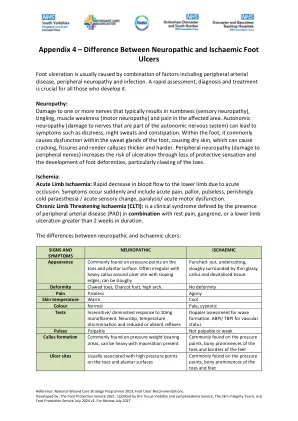
神经性和缺血性足溃疡之间的差异
溃疡脚溃疡通常是由包括周围动脉疾病,周围神经病和感染等因素组合引起的。快速评估,诊断和治疗对于所有发展的人至关重要。神经病变:对一种或多种神经的损害,通常会导致麻木(感觉神经病),刺痛,肌肉无力(运动神经病)和受影响区域的疼痛。自主神经病(对自主神经系统的一部分的神经损害)会导致头晕,夜汗和便秘等症状。在脚内,通常会在脚的汗腺内引起功能障碍,从而导致皮肤干燥,从而导致裂缝,裂缝和使愈伤组织越来越浓密。周围神经病(对周围神经的损害)通过丧失保护性感觉和脚部畸形的发展,尤其是脚趾爪的发展增加了溃疡的风险。缺血:急性肢体缺血:由于急性阻塞而导致血液流到下肢的迅速减少。症状突然发生,包括急性疼痛,苍白,无脉冲,灭绝的寒冷心脏 /急性感觉改变,麻痹 /急性运动功能障碍。慢性肢体威胁性缺血(CLTI):是一种临床综合征,由外周动脉疾病(PAD)与静止疼痛,坏疽或下肢溃疡结合使用,其持续时间大于2周。神经性溃疡和缺血性溃疡之间的差异:
缺血性中风图像中的人工智能
本文综述了当前人工智能在缺血性卒中影像学应用的研究进展,分析了主要挑战,并探讨了未来的研究方向。本研究强调了人工智能在梗塞区域自动分割、大血管闭塞检测、卒中结局预测、出血性转化风险评估、缺血性卒中复发风险预测、侧支循环自动分级等领域的应用。研究表明,机器学习(ML)和深度学习(DL)技术在提高诊断准确性、加速疾病识别、预测疾病进展和治疗反应方面具有巨大潜力。但这些技术的临床应用仍然面临数据量限制、模型可解释性、实时监测和更新需求等挑战。此外,本文讨论了 Transformer 架构等大型语言模型在缺血性卒中影像学分析中的应用前景,强调建立大型公共数据库的重要性,未来研究需要关注算法的可解释性和临床决策支持的全面性。总体而言,人工智能在缺血性中风管理中具有重要的应用价值;但必须克服现有的技术和实践挑战才能实现其在临床实践中的广泛应用。
基于脑电图检测缺血性中风的可行性
2024 年 6 月 25 日 摘要 目标:使用简化的数学方法定量探索单个皮质神经元细胞体之间的跨膜电位差异如何产生脑电图 (EEG) 的皮肤表面电位,以及如何在院前环境中使用 EEG 检测缺血性中风。方法:从静电学、解剖学和生理学的基本原理出发,可以表征单个皮质神经元细胞体激活过程中产生的表观偶极子的强度。皮质神经元中的瞬时偶极子强度取决于其细胞体的大小和表面积、其电容以及细胞体上出现的跨膜电位差异。EEG 的总电位是许多单个偶极子强度、方向和与电极的距离的函数。皮质神经元活动和放电率降低模拟了急性缺血对一个或两个 EEG 电极下组织的影响。结果:如果在任何时刻,25 个细胞体在最靠近皮肤表面电极的 1 cm 3 体积的灰质中随机活动,则可以模拟临床上真实的 EEG 记录。仅在一个 EEG 电极下完全停止神经活动会导致总体 EEG 信号幅度和频率略有下降。但是,在两个 EEG 电极下,神经活动减少到正常值的 5% 到 50% 之间,会导致 EEG 幅度与正常值相比下降 30% 到 70%。结论:这种电活动变化可用于快速早期检测急性缺血性中风,可能加快溶栓或再灌注治疗,前提是两个电极都位于缺血区域,并将信号与头部另一侧的正常信号进行比较。关键词 : 动作电位、救护车、诊断、偶极子、早期干预、脑电图、缺氧、发病率、神经元、护理人员、即时诊断系统、院前诊断、快速、再灌注、血栓溶解、治疗时间、TPA、远程医疗
“这个心电图提示缺血!”
1% 至 5% 的普通人群在心电图上发现与 LVH 一致的表现。用于检测结构性 LVH 的心电图标准诊断准确性差异很大,并且根据测试的具体标准、研究人群以及用于确定真正 LVH 的成像方式(例如超声心动图或心脏 MRI [CMR])而有所不同。大多数研究报告了低敏感性和高特异性 2 。MESA 研究表明,基于阳性 Sokolow-Lyon 或 Cornell 电压标准 3 ,检测 CMR 确定的 LVH 的敏感性和特异性分别为 22.4% 和 95.1%。心肌与心电图电极之间体组织(肥胖)、空气(慢性阻塞性肺病、气胸)、液体(心包或胸腔积液)或纤维组织(冠状动脉疾病、结节病或淀粉样变性)增多的情况会降低 QRS 波的振幅,从而降低诊断 LVH 的电压标准的敏感性。相反,瘦弱的体型和左侧乳房切除术可能会增加 QRS 振幅,从而降低电压标准的特异性 4 。高血压是 LVH 最常见的原因。多达三分之一的高血压患者的心电图与 LVH 相符 2 。高血压是各种药物的副作用,包括常用药物,如类固醇(如泼尼松)和非甾体抗炎药(如布洛芬),以及不太常见的