XiaoMi-AI文件搜索系统
World File Search System耐药机制导致 Her2+ 乳腺癌中存在可靶向的蛋白质稳态脆弱性
由于获得性耐药率高,致癌激酶抑制剂在临床上表现出短暂的反应。我们之前表明,药理学利用致癌基因诱导的蛋白毒性应激可以成为致癌基因靶向治疗的可行替代方案。在这里,我们对使用 Her2 抑制剂治疗 Her2+ 乳腺癌细胞过程中的转录组学、代谢组学和蛋白质稳态扰动进行了广泛的分析,涵盖了药物反应、耐药性、复发和停药阶段。我们发现,急性 Her2 抑制除了阻断有丝分裂信号传导外,还会导致葡萄糖摄取显著下降,糖酵解和整体蛋白质合成停止。在长期治疗期间,Her3 的补偿性过表达允许重新激活有丝分裂信号通路,但无法重新启动葡萄糖摄取和糖酵解,导致蛋白毒性 ER 应激,从而维持蛋白质合成阻滞和生长抑制。由于 eIF2 磷酸酶 GADD34 的过度表达,在长期 Her2 抑制期间,ER 应激下 Her3 介导的细胞增殖得以实现,这种过度表达将蛋白质合成阻滞与 ER 应激反应分离,从而允许细胞主动生长。我们表明,在获得性抗 Her2 治疗耐药性期间产生的促有丝分裂和蛋白质稳态信号失衡会对内质网质量控制机制的抑制产生特定的脆弱性。后者在药物停药期更为明显,其中 Her2 的去抑制会导致下游信号通路急剧激增并加剧蛋白质稳态失衡。因此,对致癌激酶抑制剂的获得性耐药机制可能会产生可在临床中利用的次级脆弱性。
DUSP4 通过调节 MITF 保护 BRAF 和 NRAS 突变黑色素瘤免受致癌基因过量的影响
MAPK 抑制剂 (MAPKi) 仍然是转移性黑色素瘤标准治疗的重要组成部分。然而,对这些药物的获得性耐药性限制了它们的治疗效果。肿瘤细胞可以通过重新激活 ERK 而对 MAPKi 产生抗性。当发生这种情况时,肿瘤通常对停药变得敏感。这种药物成瘾表型是由致癌途径的过度激活引起的,这种现象通常被称为致癌基因过量。几种反馈机制参与调节 ERK 信号传导。然而,在突变黑色素瘤中充当致癌基因过量守门人的基因仍然未知。在这里,我们证明 ERK 磷酸酶 DUSP4 的耗竭会导致药物初治和药物耐药突变黑色素瘤细胞中的 MAPK 活化达到毒性水平。重要的是,ERK 过度激活与谱系定义基因(包括 MITF)的下调有关。我们的研究结果为治疗获得性 MAPKi 耐药性和无法耐受 MAPKi 的突变黑色素瘤患者提供了一种替代治疗策略。
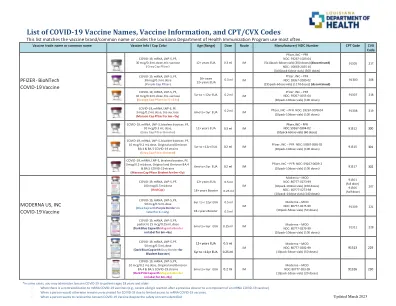
LDH 最常用的 COVID-19 疫苗 2022 年 7 月_Vial Colors.xlsx
当存在 mRNA COVID-19 疫苗禁忌症时(例如,在之前接种疫苗后或对 mRNA COVID-19 疫苗的某种成分产生严重过敏反应) 当由于 mRNA COVID-19 疫苗的可获得性有限而无法接种 COVID-19 疫苗时。 当尽管存在安全问题,但仍想接种 Janssen COVID-19 疫苗时 2023 年 3 月更新
成人肺炎球菌疫苗接种时间
脑脊液漏 慢性心脏/肝脏/肺部疾病 慢性肾功能衰竭* 吸烟 人工耳蜗 先天性或获得性无脾* 先天性或获得性免疫缺陷* 糖尿病 全身恶性肿瘤* HIV 感染* 霍奇金病* 医源性免疫抑制* 白血病* 淋巴瘤* 多发性骨髓瘤* 肾病综合征* 镰状细胞病或其他血红蛋白病* 实体器官移植*
PRT2527是一种新型高度选择性细胞周期蛋白依赖性激酶9(CDK9)抑制剂,具有有效的抗肿瘤活性,与BTK和BCL2抑制作用结合使用
用诸如Venetoclax之类的抑制剂靶向BCl2通常会导致癌细胞对其他促生物存在的Bcl2家族成员(例如MCL1)的依赖性,并且是对Bcl2抑制剂的固有和获得性抗性的常见机制。与CDK9抑制剂PRT2527与Venetoclax结合使用MCL1的间接靶向可以克服抵抗力,并导致血液恶性肿瘤中凋亡的协同诱导
EGFR-TKI 在 NSCLC 中的挑战以及草药和活性化合物的潜在作用:从机制到临床实践
表皮生长因子受体(EGFR)突变是非小细胞肺癌(NSCLC)中最常见的致癌驱动因素。表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)广泛应用于肺癌的治疗,尤其是晚期NSCLC的一线治疗,EGFR-TKI单药治疗较标准化疗取得了更好的疗效和耐受性。然而,EGFR-TKI的获得性耐药性和相关不良事件对肺癌的靶向治疗构成了重大障碍。因此,迫切需要寻求有效的干预措施来克服这些限制。天然药物在逆转EGFR-TKI的获得性耐药性和减少不良事件方面表现出潜在的治疗优势,为EGFR-TKI联合治疗带来了新的选择和方向。本文系统阐述了EGFR-TKI的耐药机制、各代EGFR-TKI在NSCLC协同治疗中的临床策略、EGFR-TKI治疗相关不良反应以及中医药在克服EGFR-TKI耐药及不良反应中的潜在作用。中药及活性成分具有通过多途径、多机制整体调控发挥协同作用的潜力,联合靶向治疗,有望成为NSCLC治疗的创新模式。
阿伯丁市疫苗接种中心 2025 年 2 月通讯......
从 LGBT+ 社区的角度探讨性健康话题,了解他们的具体需求和文化差异。了解更安全的性行为以及如何获得医疗保健。LGBT+ 社区的性健康讨论了不同类型的性传播感染、传播媒介、检测和治疗方案 - 同时承认并强调了 LGBT+ 人群在获得性医疗保健时面临的挑战。无需预约 - 直接前来即可。
扩张型心肌病:病因、机制以及当前和未来的治疗方法
扩张型心肌病的传统定义是,在没有异常负荷条件(如原发性瓣膜疾病)或足以导致心室重塑的严重冠状动脉疾病的情况下,存在左心室或双心室扩张或收缩功能障碍。这一定义被认为过于严格,因为不伴有扩张的左心室运动减少可能是扩张型心肌病的初期表现。扩张型心肌病的病因包括遗传(原发性扩张型心肌病)或后天因素(继发性扩张型心肌病)。后天因素包括感染、毒素、癌症治疗、内分泌病、怀孕、心动过速和免疫介导疾病。5-15% 的获得性扩张型心肌病患者携带可能致病或致病基因变异(即基因突变)。因此,诊断测试和治疗方法应始终考虑遗传和后天因素。该研讨会将重点关注当前的多维诊断和治疗方法,并讨论可能推动未来治疗的潜在病理生理学,旨在修复或替换现有的基因突变,或针对遗传性或获得性扩张型心肌病的特定炎症、代谢或促纤维化驱动因素。
利用 PROTAC 技术克服癌症药物耐药性
抗癌药物耐药性是持续成功治疗恶性肿瘤的主要障碍。目前发现,抑制癌症进展中指示的蛋白质的疗法由于获得性耐药性而失效,而获得性耐药性通常是由突变或过度表达的蛋白质靶标引起的。通过劫持细胞泛素蛋白酶体蛋白质降解机制,蛋白水解靶向嵌合体 (PROTAC) 为癌症治疗提供了一种具有各种潜在优势的替代治疗方式。过去 5 年,已经开发出针对多种已知癌症靶标的 PROTAC,这为以前无法治疗的恶性肿瘤患者提供了新的缓解选择,并为下一代化合物奠定了基础。PROTAC 的一个显着优势是,它们可以克服传统靶向疗法的一些耐药机制,这得到了最近许多研究的证据支持。最近,一些团体已经开始研究使用 PROTAC 成功降解导致癌症对一线治疗产生耐药性的突变靶标。在这篇评论中,我们重点分析了针对癌症抗性的 PROTAC 的发展以及在寻找新的成功疗法时赋予它的目标。