XiaoMi-AI文件搜索系统
World File Search System摘要。 Zulfahmi,Pertiwi SA,Rosmaina,Elfianis R,Gulnar Z,Zhaxybay T,Bekzat M,Zhaparkulova G. 2023。
摘要。Zulfahmi,Pertiwi SA,Rosmaina,Elfianis R,Gulnar Z,Zhaxybay T,Bekzat M,Zhaparkulova G.2023。使用RAPD标记物的四种Matoa品种(Pometia pinnata forst&Forst)的母树的分子鉴定。生物多样性24:1524-1529。Pekanbaru City有四个Matoa(Pometia pinnata Forst&Forst)品种,即红色马托阿,黄色马托阿,绿色马托阿和黑色马托阿,但尚无MATOA品种遗传变异的知识。这项研究的目的是使用随机扩增的多态性DNA(RAPD)标记来评估MATOA品种之间的遗传变异,并确定特定标记以区分Matoa品种。最初筛选了18个引物,并使用RAPD标记用十二个引物分析了四个Matoa品种。这项研究的结果发现,十二个选择的RAPD引物产生了39个片段,片段尺寸范围为200至1500 bp。碎片多态性的百分比为80.41%,表明MATOA品种的遗传变异很高。这项研究中MATOA的高遗传变异是由于该领域的Matoa品种之间的交叉授粉引起的。11个引物可以用特定带区分四个Matoa品种。育种者和农民可以利用获得独特的带,以选择父母的基础,以改善Matoa,品种或克隆保护,发现托儿所中幼苗纯度的遗传,并验证将要种植的幼苗的独创性。
基础编辑:进步和治疗机会
作为我们对基因组DNA的主要序列影响人类健康的理解,基因组编辑的治疗潜力已经出现。这场关于我们如何看待人类健康和疾病的革命在很大程度上是由基因组测序技术的快速进步所驱动的,这些技术揭示了遗传疾病的病因突变。此外,我们越来越接近精确医学的实现:基于患者的个体特征(例如其基因组序列)的预防和治疗策略的发展。因此,对于这些领域的研究人员来说,这是一个令人兴奋的时刻,因为我们应对利用基因组编辑来治疗和治愈遗传疾病的一些最知名的障碍。大约一半已知的致病遗传变异是由于单核苷酸变体(SNV)引起的,这突出了需要开发具有高效率1的方法和工具的方法1。超过96%的人遗传变异是SNV,目前99%以上缺乏临床解释2。因此,引入SNV的工具也将证明是必不可少的,即提高我们对人类遗传变异如何影响健康3 - 7的理解。要用作治疗性,基因组编辑工具必须表现出较高的靶向效率和最小的有害或不需要的脱靶编辑,并且可传递到感兴趣的器官。重要的是要注意,疾病靶标将决定必须满足这些标准的确切程度。在现场的早期努力使用了诸如锌指核酸酶和类似转录激活剂样效应子核酸酶(TALENS)的平台,但是这些方法因设计和验证新的锌指核酸酶或塔伦蛋白的需求而受到阻碍。但是,这些广泛的蛋白质重新设计要求被发现,机械阐明
单细胞幻象时代的表达定量性状基因座研究
全基因组关联研究表明,基因表达的调节桥梁遗传变异和复杂表型。构造的批量转录组以及连锁分析(表达定量性状基因座(EQTL)映射)的提出了我们对在复杂表型中遗传变异和基因调节之间关系的理解。 然而,由于基因表达的调节倾向于细胞型特异性,因此批量转录组学具有遗传局限性。单细胞RNA-seq技术的出现现在可以通过单细胞EQTL(SC- EQTL)识别基因表达的细胞类型特异性调节。 在这篇综述中,我们首先提供了SC-EQTL研究的概述,包括数据处理和SC-EQTL的映射过程。 然后,我们讨论SC-EQTL分析的好处和局限性。 最后,我们概述了SC-EQTL发现的当前和未来应用。提出了我们对在复杂表型中遗传变异和基因调节之间关系的理解。然而,由于基因表达的调节倾向于细胞型特异性,因此批量转录组学具有遗传局限性。单细胞RNA-seq技术的出现现在可以通过单细胞EQTL(SC- EQTL)识别基因表达的细胞类型特异性调节。在这篇综述中,我们首先提供了SC-EQTL研究的概述,包括数据处理和SC-EQTL的映射过程。然后,我们讨论SC-EQTL分析的好处和局限性。最后,我们概述了SC-EQTL发现的当前和未来应用。
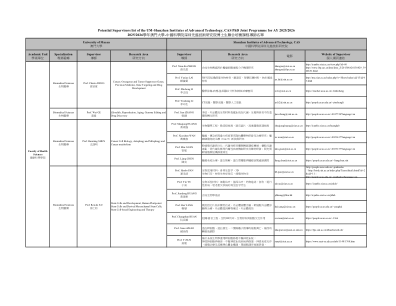
SZIAT_潜在导师名单_联合博士项目_2526_已确认.xlsx
生物信息学,检测影响神经退行性疾病,特别是阿尔茨海默病的遗传变异;神经退行性疾病的多组学整合;单细胞和空间转录组水平上神经退行性疾病的新机制
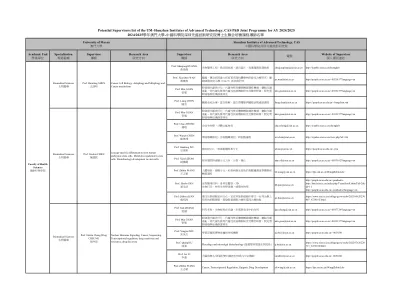
siat_potential主管list_phd intim programme_2425_26022024.xlsx
生物信息学,检测影响神经退行性疾病的遗传变异,尤其是阿尔茨海默氏病;神经退行性疾病的多摩学整合;单细胞和空间转录组中神经退行性疾病的新机制
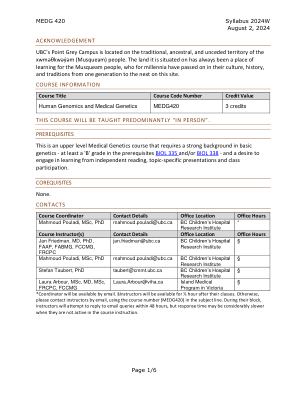
MEDG 420 教学大纲 2024W 2024 年 8 月 2 日 第 1/6 页
模块 1:识别导致孟德尔疾病的遗传变异 (Jan Friedman) 9 月 4 日星期三 – 遗传变异 9 月 9 日星期一 – 疾病基因识别 I 9 月 11 日星期三 – 疾病基因识别 II 9 月 16 日星期一 – 疾病基因识别 III 9 月 18 日星期三 – 疾病基因识别 IV 和人类遗传变异 9 月 23 日星期一 – 模块 1 嘉宾,Shelin Adam,理学学士、理学硕士、遗传咨询师、BC 儿童医院 模块 2:功能基因组学 (Mahmoud Pouladi) 9 月 25 日星期三 – 动物模型 – 无脊椎动物:蠕虫和苍蝇 9 月 30 日星期一 – 没有课程 – 真相与和解国庆日 10 月 2 日星期三 – 动物模型 – 脊椎动物:斑马鱼、鼠类和其他模型 10 月 7 日星期一 – 细胞模型 – 永生化、单倍体和 hPSC 模型 10 月 9 日星期三 – 正向遗传学/遗传筛选 10 月 14 日星期一 – 没有课程 – 感恩节 10 月 16 日星期三 – 功能基因组学项目和讨论 10 月 17 日星期四 – 第 2 部分嘉宾,待定 第 3 部分:基因治疗 (Stefan Taubert) 10 月 21 日星期一 – 什么是基因治疗?10 月 23 日星期三 – 基因治疗载体 10 月 28 日星期一 – 基因增强治疗
针对数千种人类致病变异的 CRISPR 主编辑器的自动设计
1. 纽约基因组中心,纽约州纽约市,美国。2. 纽约大学生物学系,纽约州纽约市,美国。† 这些作者贡献相同。 * 电子邮件:neville@sanjanalab.org 关键词:Prime 编辑、CRISPR、致病变异、ClinVar、人类遗传变异
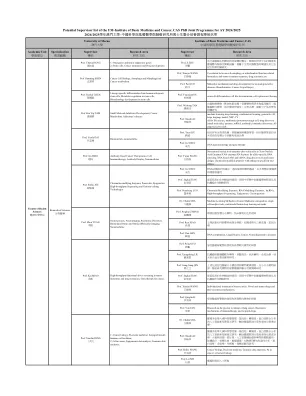
ibmca_potential主管List_joint Phd Programmes_2425_28022024.xlsx
生物信息学,检测影响神经退行性疾病的遗传变异,尤其是阿尔茨海默氏病;神经退行性疾病的多摩学整合;单细胞和空间转录组中神经退行性疾病的新机制
“科学和技术研究项目支持计划”
药物基因组学超出了药物遗传学的边界。药物基因组学不仅关注奇异遗传变异及其直接药物相关性,不如说明整个基因组及其对药物反应的功能的集体影响。为此,它结合了不同的技术,例如分子生物学,生物化学和幻象。
突变稳健性和缓冲基因在进化中的作用
生物体依靠突变来促进适应性进化。然而,许多突变会对适应性产生负面影响。因此,细胞可能进化出了影响突变表型效应的机制,从而赋予了突变稳健性。具体来说,所谓的缓冲基因被认为直接或间接地与遗传变异相互作用并降低其对适应性的影响。环境或遗传扰动可以改变缓冲基因和遗传变异之间的相互作用,从而揭示遗传变异的表型效应,从而为自然选择提供变异来源。本综述概述了我们对突变稳健性和缓冲基因的理解,并以伴侣基因 HSP90 为关键例子。它讨论了缓冲基因是否仅影响现有变异或也与新生突变相互作用,突变稳健性如何影响进化,以及突变稳健性是否可能是一种进化特征,还是仅仅是复杂遗传相互作用的副作用。