XiaoMi-AI文件搜索系统
World File Search Systemdendrobium moschatum(银行)SW的DNA条形码。标本
自然界分布稀疏的树突属是最大的兰花科之一。DNA条形码可能是快速,准确鉴定树突物种的最佳选择。本研究的目的是使用DNA条形码技术来描述树突物种。在这里,我们使用了dendrobium sp的标本。从Makawanpur的Brindaban植物园(540 m ASL)收集为测试对象。我们从标本中放大并测序了三个叶绿体基因座,RBCL(Rorose-1,5-双磷酸羧化酶),MATK(成熟酶K)和PSBA-TRNH(基因间间隔)。我们从NCBI中检索了十二个质体序列,代表了六种树枝状物种(D. Candidum,D。Crepidatum,D。Chrysanthum,D。Denneanum,D。Fimbriatum和D. Moschatum)在尼泊尔报道。同样,还检索了一个质子质体的质体胶质体,以用作组外。从每个登录中提取RBCL,MATK和PSBA-TRNH的各个对齐序列。使用Mega X的最大似然方法进行进化分析。结果表明,与用单个基因座序列生成的序列相比,与所有三个基因座(RBCL,MATK和PSBA-TRNH)的组合序列产生的进化树更好。但是,需要其他标记才能提高准确性。
使用 PBGENE-PMM 转移异质体:针对 m.3243A>G 相关线粒体肌病的基因编辑疗法
本演示文稿包含前瞻性陈述,任何相关演示文稿也可能包含前瞻性陈述,其含义符合 1995 年《私人证券诉讼改革法》的规定。公司打算让此类前瞻性陈述受到《1933 年证券法》(经修订)第 27A 节和《1934 年证券交易法》(经修订)第 21E 节中前瞻性陈述的安全港条款的约束。本文和任何相关演示文稿中包含的所有与历史事实无关的陈述均应被视为前瞻性陈述,包括但不限于有关我们候选产品和基因编辑方法的临床前和临床开发、研究进展和预期安全性、有效性和益处的陈述,包括编辑效率、确定的结果、治疗编辑、安全性和差异化方面; ARCUS 基因编辑方法在治疗 m.3243 相关 PMM、常见缺失(del_mtDNA 4977)和 m.5024C>T 方面的治疗潜力,包括 ARCUS 以高特异性优先靶向和消除突变型 m.3243G、del_mtDNA 4977 和 m.5024C>T mtDNA 的能力,且没有脱靶活性,CTA 和/或 IND 申请的预期时间,mitoARCUS 转移异质体的能力,以及我们基因编辑方法的预期安全性、有效性和益处;ARCUS 核酸酶对基因插入、大基因缺失、线粒体基因编辑和其他复杂基因编辑方法的适用性;以及调控过程的预期时间。在某些情况下,您可以通过“目标”、“预期”、“方法”、“相信”、“考虑”、“可能”、“旨在”、“估计”、“期望”、“目标”、“打算”、“看起来”、“可能”、“使命”、“计划”、“可能”、“潜在”、“预测”、“项目”、“承诺”、“追求”、“应该”、“目标”、“将”、“会”等词语或表达来识别前瞻性陈述,或者这些词语或类似词语或表达的否定形式旨在识别前瞻性陈述,但并非所有前瞻性陈述都使用这些词语或表达。
利用原生质体再生技术对野生四倍体番茄 Solanum peruvianum 进行无 DNA CRISPR-Cas9 基因编辑
*通讯作者:yalin@sinica.edu.tw † 资深作者 C.-SL、Y.-CL、JS 和 M.-CS 构思并设计了实验。C.-TH 和 Y.-HY 进行了 CRISPR-Cas9 实验。C.-TH、Y.-HY、Q.-WC、J.-JY 和 F.-HW 进行了原生质体再生、细胞生物学、分子生物学和靶向诱变实验。SL 进行了 SpCas9 纯化。Y.-LW 进行了 WGS 文库制备和 qPCR 分析。P.-XZ、T.-LW 和 Y.-CL 进行了生物信息学分析。Y.-HC、C.-TH、C.-SL、Q.-WC 和 F.-HW 进行了病毒相关分析。C.-TH 进行了细胞生物学。C.-TH 和 S.-IL 进行了嫁接。 JS、M.-CS、Y.-CL 和 C.-SL 在所有合著者的帮助下撰写了手稿。所有作者都阅读并批准了最终稿件。根据作者须知 (https://academic.oup.com/plphys/pages/General-Instructions ) 中所述的政策,负责分发与本文所述研究结果相关的材料的作者是 Yao-Cheng Lin (yalin@sinica.edu.tw)。
卷心菜(Brassica oleracea var. capitata L.)的优化……
基因组编辑技术,例如成簇的规律间隔短回文重复序列/CRISPR 相关系统 (CRISPR/Cas9),无疑正在成为改良粮食作物和应对农业挑战不可或缺的工具。在本研究中,评估了影响转化效率的关键因素,例如 PEG4000 浓度、孵育时间和质粒量,以实现将 CRISPR/Cas9 载体有效递送到卷心菜原生质体中。使用扩增子测序,我们证实了 PEG4000 浓度和孵育时间对诱导的目标突变有显著影响。通过优化转化方案,以 40 µg 质粒和 50% PEG4000 孵育 15 分钟,实现了 26.4% 的编辑效率。虽然这些因素强烈影响突变率,但转化原生质体的活力仍然很高。我们的发现将有助于成功编辑卷心菜和其他芸苔属植物的基因组,也有助于依赖原生质体瞬时转化方法的基因功能分析和亚细胞定位等研究领域。
从无DNA的植物再生葡萄藤原生质体Simone scintilla 1*,Umberto salvagnin 1,Lisa Giacomelli 2,Tieme Zeilmaker 2,
从无DNA编辑的葡萄藤原生质体中的植物再生Simone scintilla 1*,Umberto salvagnin 1,Lisa Giacomelli 2,Tieme Zeilmaker 2,Mickael A. Mickael A. Malnoy A. Malnoy 1,Jeroen Rouppe Van der Voort 2,Claudio Moser 1。1果实作物,研究与创新中心的基因组学和生物学系,E. Mach 1,I-38010,San Michele A/Adige(TN)意大利; 2 Enza Zaden,Haling 1-E,1602 dB,Enkhuizen,荷兰。*通讯作者:Simone Scintilla博士(Simone.scintilla@unitn.it)。抽象的CRISPR-CAS技术已广泛扩展了植物育种中基因组编辑的应用领域,从而使遗传库中可能的特定和最小突变。关于标准基因组编辑技术,可以以核糖核蛋白(RNP)的形式引入CRISPR-CAS机械,从而避免将外源性DNA引入细胞中。对将无DNA递送到植物细胞中应用中的兴趣不断增加,尤其是在有价值的木本植物精英品种的情况下,CRISPR-CAS9技术将保留其基因型,同时仍导致靶向遗传修饰。通过确保CRISPR-CAS DNA-RNP作为RNP的无效递送,并且由于单个编辑的单元将不存在嵌合体,因此,使用CRISPR-CAS DNA-无需递送,非常适合新育种技术的需求。然而,通常通过低编辑效率和不成功的再生过程来阻碍木质植物中原生质体的细胞培养。深红色的L.胚胎愈伤组织。此策略符合无DNA策略要求。我们在这里描述了一种成功的无DNA方法,以获得完全编辑的葡萄植物,该方法是从V. vinifera cv获得的原生质体中再生的。在浓霉敏感性基因VVDMR6-2上编辑了转染的原生质体。再生的编辑植物表现出1bp或2bp的纯合缺失,以及1BP的纯合插入。引言基因组编辑技术允许以高度精确度修改细胞DNA。尤其是随着CRISPR-CAS9的出现(群集定期间隔短的短质重复 - CAS9)技术,基因组编辑的应用领域已被广泛扩展。该系统基于通过互补的RNA序列和CAS核酸酶介导的DNA双链破裂对DNA编辑位点的识别,这使得插入,缺失,甚至仅仅使一个核苷酸的修饰成为可能。因此,尤其是在木质植物遗传改善的情况下(例如葡萄藤或苹果)精英品种,CRISPR-CAS9技术可确保其基因型保存,同时导致靶向遗传修饰。CRISPR-CAS成分可以以核酸的形式引入细胞内(即DNA/mRNA编码整个系统),或以核糖核蛋白(RNP)复合物的形式进行编码。虽然DNA可以整合到基因组中,而mRNA受其内在不稳定性的影响,但RNP的直接细胞递送打开了有吸引力的场景,因为它有可能体现出强大的方法论,导致特定而最小的突变,而没有外源性DNA的痕迹(Woo等,2015)。从这种角度来看,与经典的转基因生物相比,对植物的应用兴趣可能会更好地接受消费者(Saleh等,2021)。到目前为止,已经提出了三种主要策略将CRISPR-CAS系统输送到植物细胞中。1)使用工程化的农杆菌,可以轻松克服植物细胞壁。然而,该策略采用外源质粒DNA,这些DNA含有农杆菌的DNA部分,在转化后,该策略在细胞DNA中积分为细胞DNA。对于木本植物,外源性DNA只能通过杂交去除,从而导致遗传背景的变化。成功地应用于包括木本植物在内的许多农作物的替代方法,包括T-DNA的分子切除(Dalla Costa等,2020),几乎完全去除外源性DNA。但是,剩余的最小残留外国DNA可能与许多国家的当前严格转基因生物法规不相容。2)粒子轰击使用装有生物材料的纳米颗粒子弹来射击植物组织,从而超过了细胞壁垒,并释放了纳米颗粒装载的生物货物以诱导基因组编辑。尽管如此,各种物理参数严重影响了这种方法的效率。,并非所有细胞都会被子弹击中,因此下游再生过程可能会引起嵌合植物。3)替代解决方案是暂时清除细胞壁,有效地将生物材料递送到单个细胞中。根据此策略,细胞壁是酶法消化的,因此提供了一个“裸”植物细胞(即原生质体)由质膜界定。在有利的条件下,可以通过PEG浸润,电穿孔或LiPofection轻松实现RNP的细胞递送。2-3天后,恢复了细胞壁,进一步的细胞划分
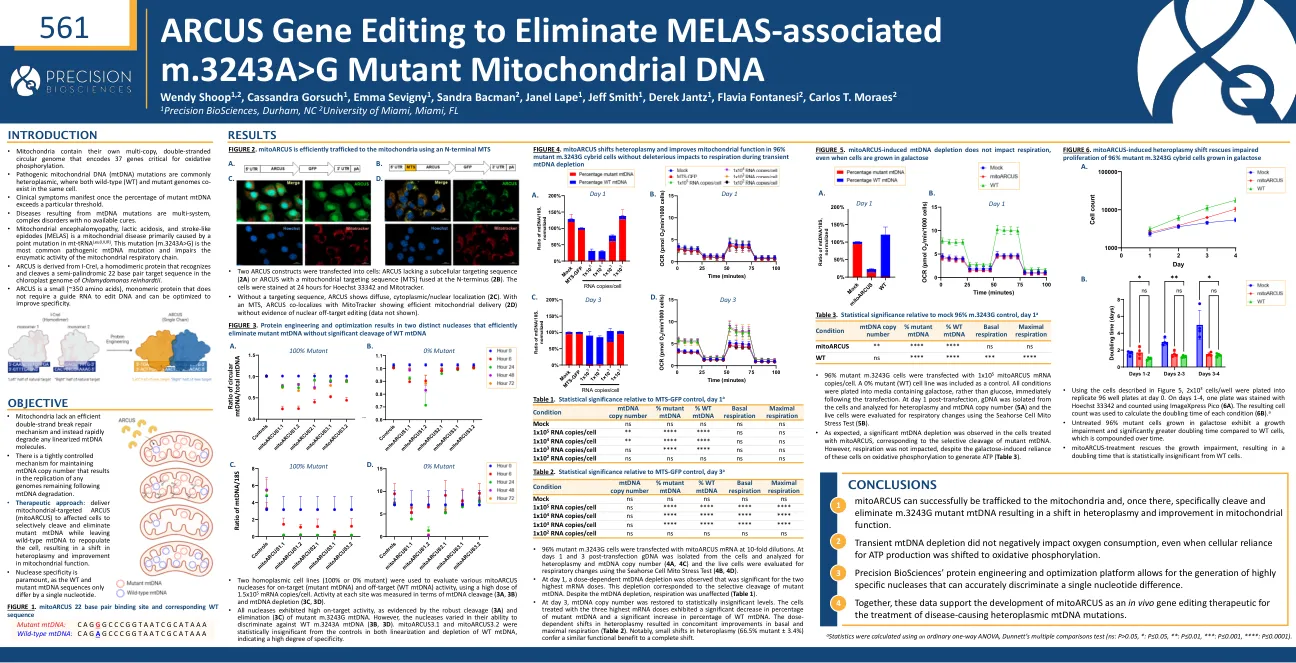
ARCUS 基因编辑消除 MELAS 相关 m。......
• 96% 的突变型 m.3243G 细胞以 10 倍稀释度转染了 mitoARCUS mRNA。转染后第 1 天和第 3 天从细胞中分离 gDNA,并分析异质体和 mtDNA 拷贝数(4A、4C),并使用海马细胞线粒体应激测试评估活细胞的呼吸变化(4B、4D)。 • 在第 1 天,观察到剂量依赖性 mtDNA 消耗,对于两个最高 mRNA 剂量而言更为显著。这种消耗与突变型 mtDNA 的选择性切割相对应。尽管 mtDNA 消耗,但呼吸不受影响(表 1)。 • 在第 3 天,mtDNA 拷贝数恢复到统计学上不显著的水平。用三种最高 mRNA 剂量处理的细胞表现出突变型 mtDNA 百分比显著下降和 WT mtDNA 百分比显著增加。异质体的剂量依赖性转变导致基础呼吸和最大呼吸同时改善(表 2)。值得注意的是,异质体的微小转变(66.5% 突变 ± 3.4%)带来的功能益处与完全转变相似。
恶性疟原虫富含组氨酸的蛋白质 II 的破坏可能会影响血液阶段的血红素代谢
RNA-Seq 数据表明,Pfhrp2 被破坏后,PfHO 的转录水平显著下调,从而进一步影响血红素代谢。同时,恶性疟原虫 3D7 线粒体中编码从头血红素生物合成途径相关酶的基因转录水平上调,例如 ALAS(该途径的第一个酶)和 FC,以增加寄生虫的血红素供应。然而,在寄生虫的顶质体中催化胆色素原转化为羟甲基胆烷的 PBGD 的转录表达下调。这可能减少顶质体中的血红素生物合成
使用 CRISPR-Cas9 核糖核蛋白复合物编辑康乃馨中的乙烯生物合成基因。
摘要 本研究利用CRISPR/Cas9核糖核蛋白(RNP)复合体系统对康乃馨乙烯(ET)生物合成基因[1-氨基环丙烷-1-羧酸(ACC)合成酶1(ACS1)和ACC氧化酶1(ACO1)]进行编辑。首先,验证靶基因(ACS1和ACO1)的保守区域,以生成不同的单向导RNA(sgRNA),然后使用体外切割试验验证sgRNA特异性切割靶基因的能力。体外切割试验表明,sgRNA在切割各自的靶区域方面具有很高的效率。将sgRNA:Cas9复合物直接递送到康乃馨原生质体中,并对原生质体中的靶基因进行深度测序。结果表明,sgRNA 适用于编辑 ET 生物合成基因,因为 ACO1 的突变频率范围为 8.8% 至 10.8%,ACS1 的突变频率范围为 0.2–58.5%。在对用 sgRNA:Cas9 转化的原生质体产生的愈伤组织中的目标基因进行测序时,在 ACO1 中发现了不同的 indel 模式(+ 1、- 1 和 - 8 bp),在 ACS1 中发现了不同的 indel 模式(- 1、+ 1 和 + 11)。这项研究强调了 CRISPR/Cas9 RNP 复合物系统在促进康乃馨 ET 生物合成的精确基因编辑方面的潜在应用。关键词 愈伤组织,CRISPR/Cas9,乙烯生物合成基因,Indel 模式,体外裂解,原生质体