XiaoMi-AI文件搜索系统
World File Search System布洛芬在2型糖尿病的ZDF大鼠模型中的影响
我们旨在使用肥胖的Zucker糖尿病脂肪(ZDF)大鼠作为2型糖尿病模型来研究布洛芬对2型糖尿病(T2D)的治疗潜力。ZDF大鼠是高血糖,血脂异常和表达的临界标记,与瘦门控制相反,因此反映了肥胖与促进T2D的慢性炎症之间的关系。慢性治疗(2-(4-异丁基苯基)丙酸)用于研究对病理T2D条件的影响。布洛芬降低了A1c,但仅在早期时间点(I.G.,15和30分钟)后诱导高胰岛素释放,导致AUC值的降低并转化为高HOMA-IR。此外,布洛芬显着降低了胆固醇,游离脂肪酸和HDL-C。通过抑制细胞因子/趋化因子信号传导(i.g,cox-2,icam-1和tnf-a),这可能是基于其抗炎性效应,如全血液和taq man和/inti in-flimotial cy的全血和附子性脂肪组织中所测量的(i.g,cox-2,icam-1和tnf-a)。血液中的ELISA分析。 总而言之,我们的ZDF动物研究表明,布洛芬对糖尿病并发症(例如炎症和血脂异常)的积极作用,但也表现出引起胰岛素抵抗的风险。通过抑制细胞因子/趋化因子信号传导(i.g,cox-2,icam-1和tnf-a),这可能是基于其抗炎性效应,如全血液和taq man和/inti in-flimotial cy的全血和附子性脂肪组织中所测量的(i.g,cox-2,icam-1和tnf-a)。血液中的ELISA分析。总而言之,我们的ZDF动物研究表明,布洛芬对糖尿病并发症(例如炎症和血脂异常)的积极作用,但也表现出引起胰岛素抵抗的风险。
新型JAK抑制剂SHR 0302在急性移植物抗宿主病中的预防和治疗作用
抽象的急性移植物抗宿主病(AGVHD)是同种异体造血干细胞移植(Allo-HSCT)最常见的并发症之一。Janus激酶(JAK)抑制剂被认为是AGVHD患者的可靠和有前途的药物。在AGVHD小鼠模型中评估了一种新型JAK抑制剂SHR 0302的预防性和治疗作用。观察并记录了总体存活率(OS),无进展生存期(PFS),小鼠体重,GVHD评分。分析了患病小鼠的骨髓和脾样本或患者外周血的样本。SHR0302可以预防和逆转AGVHD,并具有保留移植物肿瘤效应的小鼠模型。在功能上,SHR0302改善了OS和PFS,恢复体重,降低GVHD评分,并降低了目标组织中浸润的免疫细胞。SHR 0302治疗还增强了造血重建。从机械上讲,我们的结果表明SHR0302可以通过减少TH1并增加调节t(Treg)细胞来抑制T细胞的激活并调节辅助T(Th)细胞的分化。此外,SHR0302降低了供体T细胞上趋化因子受体CXCR3的表达,以及包括白介素(IL)-6,干扰素G(IFN-G)的细胞因子或趋化因子的分泌,肿瘤坏死因子A(TNF-A)(TNF-A),CXCL10等从而破坏了促进GVHD进展的IFN-G /CXCR3 /CXCL10轴。对AGVHD患者原代细胞的实验也证实了结果。对AGVHD患者原代细胞的实验也证实了结果。此外,SHR0302降低了JAK及其下游统计数据(AKT和ERK1/2)的磷酸化,最终调节了淋巴细胞的激活,增殖和分化。总而言之,我们的结果表明JAK抑制剂SHR 0302可以用作AGVHD患者的新型药物。
引用:Shiqian Chen,Jinzhe Sun,Huan Zhou,Hongbin Lei,Dan Zang,Jun Chen。肿瘤衍生外泌体在肿瘤微环境中的新作用。下巴J
肿瘤微环境(TME)是一个独特的生态系统,主要由肿瘤细胞,癌症相关的成纤维细胞,血管内皮细胞,周围的免疫细胞和各种间质细胞组成(1)。除了它们参与塑造TME外,这些细胞还积极分泌大量的细胞因子和趋化因子来促进肿瘤细胞的生长(2)。TME中的各种细胞类型相互作用,它们的代谢物不仅有助于能源供应,而且在细胞间信息传播中起着至关重要的作用。细胞 - 细胞通信的机制各不相同,包括通过人体流体和循环的直接接触以及遥远的相互作用,从而促进了各种信号的传播。通过外泌体运输生物介质代表特定而广泛的
先天免疫细胞在肿瘤微环境中的作用和抗肿瘤治疗中的研究进展
肿瘤微环境(TME)中的先天免疫细胞主要包括巨噬细胞,中性粒细胞,天然杀伤细胞,树突状细胞和骨髓衍生的抑制细胞。他们通过分泌各种细胞因子,趋化因子和其他因素,并确定肿瘤的发生和发育,从而发挥抗肿瘤或亲肿瘤作用。理解先天免疫细胞在肿瘤发生和进展中的作用可以帮助改善靶向TME中先天免疫细胞的治疗方法,从而增加了有利的预后的可能性。在这篇综述中,我们讨论了先天免疫细胞的细胞生物学,它们在肿瘤发生和发育中的作用以及先天免疫细胞的免疫疗法的当前状态,以便为将来的研究系和临床试验提供概述。
CRISPR-Cas9 诱导的 CCR5 Δ32 突变可作为抗 HIV-1 变体的有效基因治疗方法:综述
摘要。近五十年来,人类免疫缺陷病毒 (HIV) 一直是人类最大的流行病。尽管进行了广泛的研究,但迄今为止仍没有特定的治疗方法,CC 趋化因子受体 5,Delta 32 (CCR5 Δ32) 等位基因遗传点突变在预防获得性免疫缺陷综合征 (AIDS) 中起着至关重要的作用。这项综合研究旨在回顾在阳性患者群体中,在正选择压力下使用成簇的规律间隔短回文重复序列、Cas 9 酶 (CRISPR-Cas9) 和造血干细胞移植诱导纯合隐性缺失基因型作为表型。提出了一种方法,通过体细胞基因疗法,利用全能干细胞在受控的现代医疗设施内显著增加 Delta 32 有益突变等位基因的表达。它作用于两个功能失调的 CCR5 基因,翻译突变的 G 蛋白偶联共受体,其主要功能类似于 CXC 基序趋化因子受体 4 ( CXCR4 ),通过阻止病毒 RNA 进入 CD4 + T 辅助淋巴细胞,阻止感染并抑制病毒生命周期。这种修饰在北欧很常见,在那里它自然地以多态性 p (X=0.01) 的形式存在于高加索血统人群样本中,其中 X 是人群样本中对 HIV- 1 完全免疫的频率概率。分析了单核苷酸多态性 (SNP) 的表观遗传学,因为它们在免疫分布中起着重要作用。此外,在 CRIS-PR-Cas9 的伦理界限内进行了比较分析,以讨论所提出的方法和治疗替代方案的实际方面和挑战。此外,该研究汇集了所有可用数据并总结了先前的研究,同时为这一伦理困境提供了有希望的解决方案。最后,设计了一种方法来回答
L1抑制剂GS-4224选择性地与PD
抽象背景检查点抑制剂针对程序性细胞死亡1(PD-1)/程序性细胞死亡1配体1(PD-L1)途径是一系列免疫原性癌症类型的有效疗法。通过口服疗法阻止这一途径可以通过更大的便利性使患者受益,尤其是在组合方案中,并可以灵活地管理免疫介导的毒性。方法在工程二聚化和原始细胞靶标测定中评估了PD-L1结合活性。在体内和体内表达肿瘤模型中评估了临床前抗肿瘤活性。在晚期实体瘤患者的开放标签,多中心,顺序的剂量降低研究中评估了人类安全性,耐受性,药代动力学和生物标志物活性。评估的生物标志物包括目标占用率,流式细胞仪免疫表型,血浆细胞因子测量和T细胞受体测序。结果GS-4224结合导致PD-L1的二聚化,阻断了其与PD-1的相互作用,并导致T细胞抑制作用逆转,并增加了体外和体内肿瘤杀死的肿瘤。GS-4224的效力取决于细胞表面PD-L1的密度,其结合对PD-L1-高细胞最有效。在1阶段的剂量降低研究中,在晚期实体瘤患者中,每天以400–1,500 mg的剂量耐受治疗。结论GS-4224是一种新型的,可口服的可生物利用的小分子抑制剂Pd-L1。试用注册号NCT04049617。GS-4224的给药与外周血T细胞对血浆GS-4224的剂量依赖性增加和Free PD-L1的降低有关,PD-1阳性T细胞中KI67的增加,PD-1阳性T细胞亚群和升高的血浆细胞因子和趋化因子和趋化因子和搅拌。GS-4224显示了预期的靶标生物标志物活性的证据,包括PD-L1的参与以及与PD-L1阻断一致的免疫相关药效动力学反应的诱导。
蛋白质相互作用图谱识别了针对...的现有药物。
CoV-2,在感染期间观察到淋巴细胞减少,CD4 + 和 CD8 + T 细胞丢失,IL6、IL10、IL2R、TNFa 和 CCL2 过度产生 [16]。细胞因子风暴对呼吸系统的破坏性影响已经为人所知。这种炎症状态对神经系统的影响鲜为人知。与高水平细胞因子/趋化因子相关的慢性神经炎症与某些神经退行性疾病(多发性硬化症、帕金森病、阿尔茨海默病、阿尔茨海默病、亨廷顿病或肌萎缩侧索硬化症)的病理生理有关 [17]。在 AD 的情况下,有描述称小胶质细胞在促炎细胞因子(主要是 IL1 或 IL6)存在下失去降解 Aβ 蛋白的能力,导致致病
访问医学生选修课书
系/分部:细胞生物学 教员姓名:Deborah Andrew 研究课题:器官形成的发育遗传学;果蝇 系/分部:细胞生物学 教员姓名:Peter Devreotes 研究课题:趋化因子定向细胞迁移;信号转导 系/分部:细胞生物学 教员姓名:Peter Espenshade 研究课题:细胞胆固醇稳态调节和对缺氧的适应 系/分部:细胞生物学 教员姓名:Andrew Ewald 研究课题:发育和癌症中上皮形态发生的细胞机制和分子调控。 系/分部:细胞生物学 教员姓名:Luis Adres Garza 博士 研究课题:皮肤干细胞和前列腺素在再生和伤口愈合中的研究。 系/分部:细胞生物学 教员姓名:David Hackam 博士 研究课题:上皮表面损伤和修复的免疫调节
RSV免疫,耐用性和再感染 药学微生物手册 行业急性髓样白血病指南 FDA信件呼吁提高婴儿配方奶粉行业的安全措施(2023年3月) 课程vitae stephen clement,MD 人类处方药和生物产品标签的老年信息针对行业的标签指南 卫生与公共服务部 嗜酸性食管炎:开发治疗药物 用户费用法(PDUFA)重新授权 吸入抗真菌产品的调节视角 聚丙烯:医疗设备材料安全摘要 药物开发工具意向书确定DDT COA ... 包装插入-Fluad 从研究到紧急使用授权的Covid-19疫苗的路径 准备复杂的多价免疫原性结合物的方法 gras通知GRN 900代理响应信 阿片类镇痛药的背景REMS 包装插入-Fluad Quadrivalent 行业指南 2020年11月13日临床评论备忘录-Breyanzi 请求联合产品的FDA反馈 疫苗和相关生物产品咨询委员会2020年12月17日会议简报文件 - 赞助商附录 Moderna Covid-19疫苗VRBPAC简报 在用于药物和生物产品的复杂创新试验设计上与FDA互动 行业指南
•人类对RSV的免疫反应和潜在的新型治疗靶标的摘要。除关键抗体,细胞因子,趋化因子和其他免疫分子反应外,总结了主要细胞类型(中性粒细胞,树突状细胞,巨噬细胞,CD8 T细胞和B细胞)的作用。显示了与免疫相关途径的主要转录变化(在外周血中)。强调了中性粒细胞炎症的有害作用和CD8 T细胞介导的病毒清除率的保护作用。最后,我们重点介绍了新型治疗干预措施可能会调节免疫反应以有利于宿主的领域。1,免疫细胞募集到呼吸道; *,与疾病严重程度增加相关。
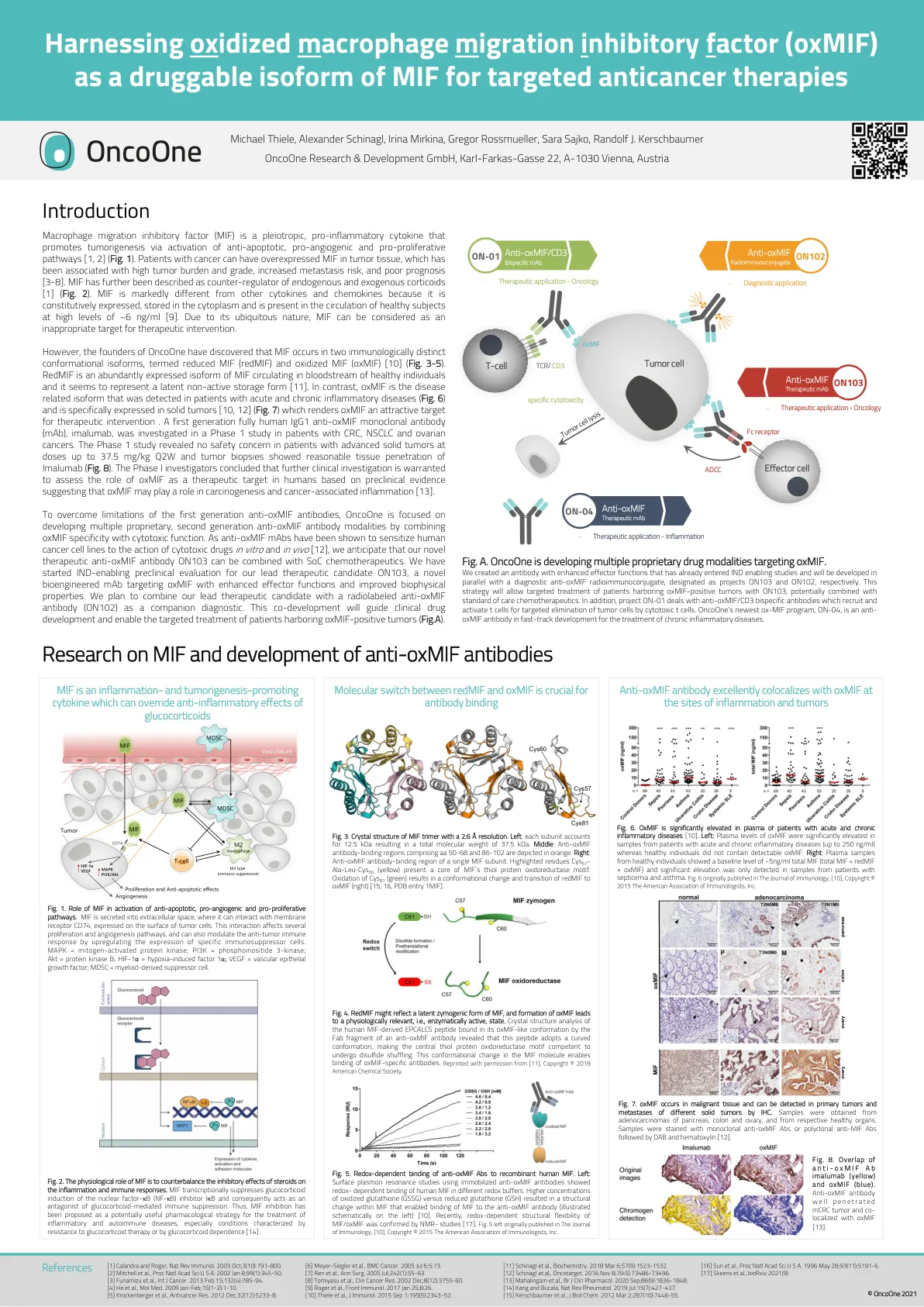
引言 MIF 的研究及抗...的开发
巨噬细胞迁移抑制因子 (MIF) 是一种多效性促炎细胞因子,通过激活抗凋亡、促血管生成和促增殖途径促进肿瘤发生 [1, 2](图 1)。癌症患者的肿瘤组织中可能存在过度表达的 MIF,这与高肿瘤负荷和分级、转移风险增加和预后不良有关 [3-8]。MIF 被进一步描述为内源性和外源性皮质激素的反调节剂 [1](图 2)。MIF 与其他细胞因子和趋化因子明显不同,因为它是组成性表达的,储存在细胞质中,并且在健康受试者的循环中以约 6 ng/ml 的高水平存在 [9]。由于其普遍存在的性质,MIF 可被视为治疗干预的不合适靶点。