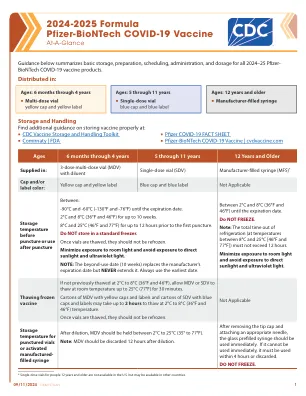
机构名称:
¥ 1.0
11 欧洲药品管理局于 2020 年 6 月开始对该疫苗进行滚动审查。辉瑞可能已与监管机构讨论过这些初步标准。由于该疫苗在 11 月签署欧盟合同后不到一个月就在美国和欧盟获得了紧急使用授权,因此这些标准不太可能出现大幅变化。然而,作为授权的一部分,EMA 建议辉瑞“随着正在进行的临床试验获得更多数据,并根据产品的制造工艺能力和稳定性数据,应重新评估并酌情修订活性物质和成品规格的可接受限度。”它还要求辉瑞引入新的规范来控制 Poly(A) 尾长,并在 2021 年 7 月之前提供更新。EMA,Comirnaty 评估报告(2021 年 2 月 19 日),https://www.ema.europa.eu/en/documents/assessment-report/comirnaty-epar-public-assessment-report_en.pdf。辉瑞最初使用反相高效液相色谱法来表征尾长。欧盟合同,第 63 页。https://www.rai.it/dl/doc/2021/04/17/1618676600910_APA%20BioNTech%20Pfizer__.pdf。
新冠疫苗研发配方的一部分
主要关键词