机构名称:
¥ 1.0
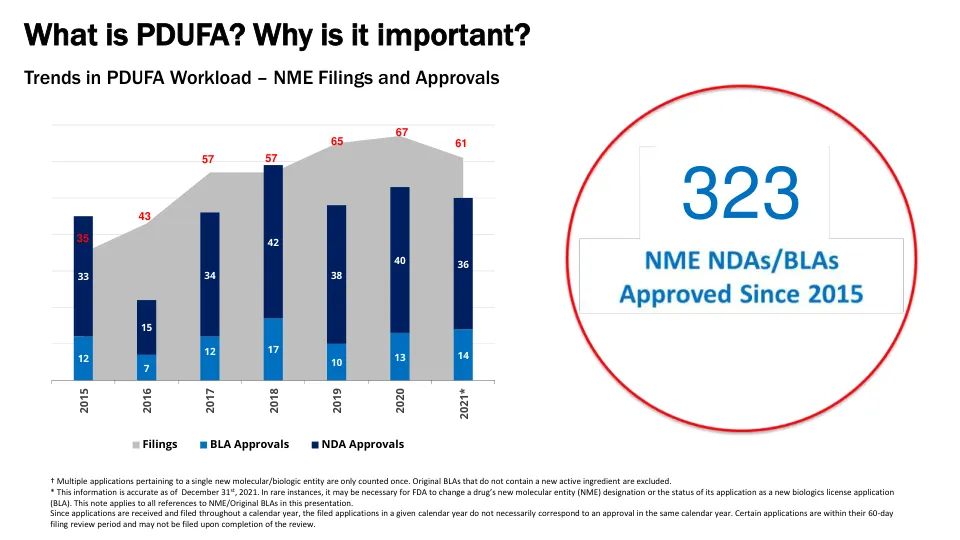
† 涉及单个新分子/生物实体的多个申请仅计算一次。不包含新活性成分的原始 BLA 不包括在内。 * 此信息截至 2021 年 12 月 31 日准确无误。在极少数情况下,FDA 可能需要更改药物的新分子实体 (NME) 指定或其申请的状态为新生物制品许可申请 (BLA)。此说明适用于本演示文稿中对 NME/原始 BLA 的所有引用。由于申请是在整个日历年内收到和提交的,因此在给定日历年提交的申请不一定对应于同一日历年的批准。某些申请处于 60 天的申请审查期内,在审查完成后可能不会提交。
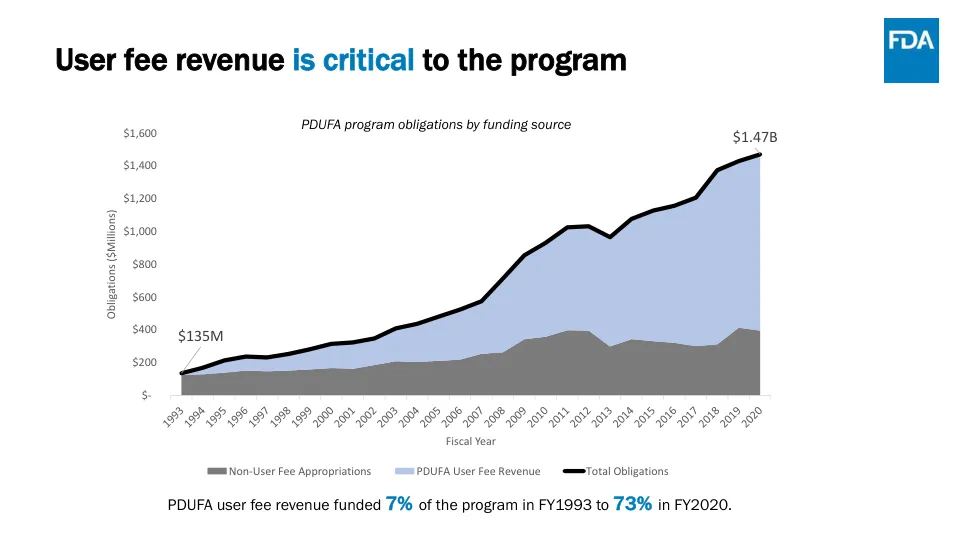
处方药使用者付费法案 (PDUFA) 概述和重新授权