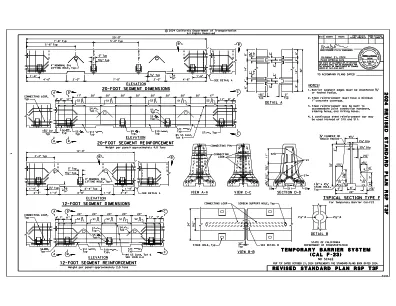
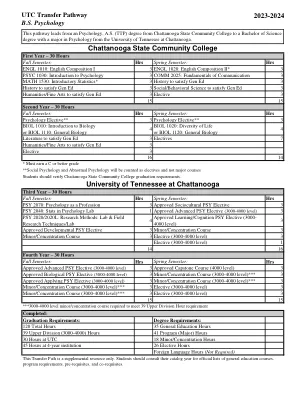
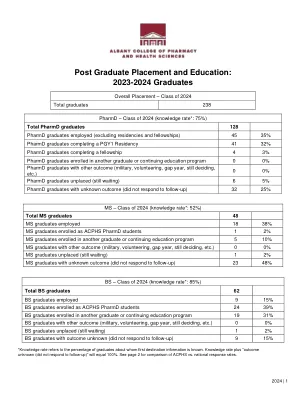
机构名称:
¥ 1.0
D-1553是第一个独立开发的KRAS G12C抑制剂,进入临床试验阶段,并在美国,澳大利亚,中国,韩国和其他国家和其他地区进行了国际多中心临床试验。2022年6月,D-1553被国家医疗产品管理局的药物评估中心(“ CDE”)授予了突破性治疗,这是CDE授予突破性治疗指定的首个国内KRAS G12C抑制剂。接受NDA的接受是基于在中国进行的临床II期,单臂注册(CTR20220745)研究的结果。该研究旨在评估D-1553单一药物在失败或不宽容标准治疗和KRAS G12C突变的晚期NSCLC受试者中的安全性,耐受性和功效,并且该研究的结果将随后在学术期刊/会议上发表。
公告2023/2024 GP ...
主要关键词