XiaoMi-AI文件搜索系统
World File Search System问卷调查 医疗器械中的人工智能
1 目录................................................................................................................ 2 2 初步说明............................................................................................................... 2 3 术语和定义............................................................................................................... 3 4 同样,必须考虑对该定义的解释的未来指导。人工智能的可认证性 ................................................................................................................ 3 5 调查问卷:一般要求 ...................................................................................................... 4 5.1 开发能力 ................................................................................................................ 4 5.2 文件 ............................................................................................................................ 5 6 调查问卷:产品开发要求 ............................................................................................. 5 6.1 预期用途和利益相关者要求 ............................................................................................. 5 6.1.1 预期用途 ............................................................................................................. 5 6.1.2 预期用户、预期使用环境 ............................................................................................. 6 6.1.3 利益相关者要求 ............................................................................................................. 7 6.1.4 风险管理和临床评估的输入 ............................................................................................. 7 6.2 软件要求 ............................................................................................................................. 9 6.2.1 功能和性能 ............................................................................................................. 9 6.2.2 用户界面 ............................................................................................................. 11 6.2.3 其他软件要求........................................................................... 11 6.2.4 人工智能的安全风险 ...................................................................................... 12 6.3 数据管理 .............................................................................................................. 13 6.3.1 训练、验证和测试数据集的收集 ........................................................................ 13 6.3.2 数据标签 ............................................................................................................. 14 6.3.3 数据(预)处理程序 ............................................................................................. 15 6.3.4 文档和版本控制 ............................................................................................. 16 6.4 模型开发 .............................................................................................................17 6.4.1 准备 ................................................................................................................ 17 6.4.2 培训 ................................................................................................................ 18 6.4.3 评估 ................................................................................................................ 18 6.4.4 文件 ................................................................................................................ 19 6.5 产品开发 ................................................................................................................ 20 6.5.1 软件开发 ............................................................................................................. 20 6.5.2 随附材料 ............................................................................................................. 20 6.5.3 可用性验证 ............................................................................................................. 22 6.5.4 临床评估 ............................................................................................................. 23 6.6 产品发布 ............................................................................................................. 24 7 调查问卷:开发后阶段的要求 ............................................................................................. 24 7.1 生产、分销、安装 ................................................................................................ 24 7.2 上市后监督 ............................................................................................................. 25 7.3退役................................................................................................................................ 26 8 参考文献...................................................................................................................... 26 8.1 法规...................................................................................................................... 26 8.2 指导...................................................................................................................... 27 8.3 标准...................................................................................................................... 27 8.4 补充参考文献...................................................................................................... 27 8.4.1 补充标准...................................................................................................... 27 8.4.2 补充标准草案...................................................................................................... 27 9 历史...................................................................................................................... 28................................................ 18 6.4.3 评估 ................................................................................................................ 18 6.4.4 文件 ................................................................................................................ 19 6.5 产品开发 ................................................................................................................ 20 6.5.1 软件开发 ................................................................................................................ 20 6.5.2 随附材料 ................................................................................................................ 20 6.5.3 可用性验证 ............................................................................................................. 22 6.5.4 临床评估 ................................................................................................................ 23 6.6 产品发布 ................................................................................................................ 24 7 调查问卷:开发后阶段的要求 ............................................................................................. 24 7.1 生产、分销、安装 ............................................................................................................. 24 7.2 上市后监督 ................................................................................................................ 25 7.3 退役 ............................................................................................................................. 26 8 参考文献 ............................................................................................................................. 26 8.1法规................................................................................................................................ 26 8.2 指导意见...................................................................................................................... 27 8.3 标准.............................................................................................................................. 27 8.4 补充参考文献.............................................................................................................. 27 8.4.1 补充标准............................................................................................................. 27 8.4.2 补充标准草案............................................................................................................. 27 9 历史............................................................................................................................. 28................................................ 18 6.4.3 评估 ................................................................................................................ 18 6.4.4 文件 ................................................................................................................ 19 6.5 产品开发 ................................................................................................................ 20 6.5.1 软件开发 ................................................................................................................ 20 6.5.2 随附材料 ................................................................................................................ 20 6.5.3 可用性验证 ............................................................................................................. 22 6.5.4 临床评估 ................................................................................................................ 23 6.6 产品发布 ................................................................................................................ 24 7 调查问卷:开发后阶段的要求 ............................................................................................. 24 7.1 生产、分销、安装 ............................................................................................................. 24 7.2 上市后监督 ................................................................................................................ 25 7.3 退役 ............................................................................................................................. 26 8 参考文献 ............................................................................................................................. 26 8.1法规................................................................................................................................ 26 8.2 指导意见...................................................................................................................... 27 8.3 标准.............................................................................................................................. 27 8.4 补充参考文献.............................................................................................................. 27 8.4.1 补充标准............................................................................................................. 27 8.4.2 补充标准草案............................................................................................................. 27 9 历史............................................................................................................................. 281 软件开发 ................................................................................................................ 20 6.5.2 随附材料 .............................................................................................................. 20 6.5.3 可用性验证 .............................................................................................................. 22 6.5.4 临床评估 .............................................................................................................. 23 6.6 产品发布 ...................................................................................................................... 24 7 调查问卷:开发后阶段的要求 ...................................................................................... 24 7.1 生产、分销、安装 ...................................................................................................... 24 7.2 上市后监督 ................................................................................................................ 25 7.3 退役 ...................................................................................................................... 26 8 参考文献 ................................................................................................................ 26 8.1 法规 ........................................................................................................................ 26 8.2 指导 ........................................................................................................................ 27 8.3 标准 ........................................................................................................................ 27 8.4 补充参考文献 ........................................................................................................ 27 8.4.1 补充标准 ...................................................................................................... 27 8.4.2 补充草案标准 ................................................................................................ 27 9 历史 ...................................................................................................................... 281 软件开发 ................................................................................................................ 20 6.5.2 随附材料 .............................................................................................................. 20 6.5.3 可用性验证 .............................................................................................................. 22 6.5.4 临床评估 .............................................................................................................. 23 6.6 产品发布 ...................................................................................................................... 24 7 调查问卷:开发后阶段的要求 ...................................................................................... 24 7.1 生产、分销、安装 ...................................................................................................... 24 7.2 上市后监督 ................................................................................................................ 25 7.3 退役 ...................................................................................................................... 26 8 参考文献 ................................................................................................................ 26 8.1 法规 ........................................................................................................................ 26 8.2 指导 ........................................................................................................................ 27 8.3 标准 ........................................................................................................................ 27 8.4 补充参考文献 ........................................................................................................ 27 8.4.1 补充标准 ...................................................................................................... 27 8.4.2 补充草案标准 ................................................................................................ 27 9 历史 ...................................................................................................................... 28................................................................................... 25 7.3 退役 ................................................................................................................ 26 8 参考文献 ................................................................................................................ 26 8.1 法规 ................................................................................................................ 26 8.2 指导 ................................................................................................................ 27 8.3 标准 ................................................................................................................ 27 8.4 补充参考文献 ................................................................................................ 27 8.4.1 补充标准 ................................................................................................ 27 8.4.2 补充标准草案 ................................................................................................ 27 9 历史 ................................................................................................................ 28................................................................................... 25 7.3 退役 ................................................................................................................ 26 8 参考文献 ................................................................................................................ 26 8.1 法规 ................................................................................................................ 26 8.2 指导 ................................................................................................................ 27 8.3 标准 ................................................................................................................ 27 8.4 补充参考文献 ................................................................................................ 27 8.4.1 补充标准 ................................................................................................ 27 8.4.2 补充标准草案 ................................................................................................ 27 9 历史 ................................................................................................................ 28
医疗器械质量体系手册 - eduquest.net
质量体系 (QS) 法规中规定的现行良好生产规范 (GMP) 要求是根据《食品、药品和化妆品 (FD&C) 法》第 520 条颁布的。这些要求要求国内或国外制造商在设计和生产用于在美国进行商业分销的医疗器械时,必须拥有一套质量体系。该法规要求为器械制定各种规范和控制措施;器械的设计必须符合这些规范;器械的生产必须符合这些规范;器械必须正确安装、检查和维护;必须分析质量数据以识别和纠正质量问题;必须处理投诉。因此,QS 法规有助于确保医疗器械在预期用途上是安全有效的。美国食品药品管理局 (FDA) 监控器械问题数据,并检查器械开发商和制造商的操作和记录,以确定是否符合 QS 法规中的 GMP 要求。
医疗器械校准的监管要求...
• Dan O’Leary – Dan O’Leary 是 Ombu Enterprises, LLC 的总裁,这是一家教育、培训和咨询公司,专注于利用分析技能和系统方法进行运营管理,实现卓越运营。– Dan 在受监管行业(包括航空、国防、医疗设备和临床实验室)的质量、运营和项目管理方面拥有 30 多年的经验。– 他拥有数学硕士学位;是 ASQ 认证的生物医学审计师、质量审计师、质量工程师、可靠性工程师和六西格玛黑带;并获得 APICS 资源管理认证。• Ombu Enterprises, LLC – Ombu 与小型制造公司合作,提供卓越运营方面的培训和执行。Ombu 专注于运营管理的分析技能和系统方法,帮助公司实现高效、有效的流程和法规遵从性。
药品和医疗器械安全信息
Xocova 和 Lagevrio 是用于治疗 COVID-19 患者的抗病毒药物,由于这些药物具有致畸风险,因此孕妇或可能怀孕的女性禁用。Xocova 和 Lagevrio 的致畸风险在风险管理计划 (RMP) 中被列为重要潜在风险。除了第 2. 禁忌症部分和第 9. 特殊背景患者的注意事项部分中的警告声明外,还准备了医护人员材料/患者材料,并将其作为额外的风险最小化活动提供。基于 MAH 报告了多起在服用 Xocova 或 Lagevrio 后发现怀孕的病例,已多次发布使用基于 RMP 准备的医护人员材料/患者材料的请求。然而,到目前为止,在服用每种药物后发现怀孕的病例断断续续地被报告(下表)。表格。药品持有者报告的服用这些药物后发现怀孕的病例数(按财政年度和累计数据)(Xocova) 累计病例数:54 例(信息接收时间:2022 年 11 月 22 日至 2024 年 10 月 31 日) 财政年度(信息接收时间) 2021 财年 2022 财年 2023 财年 2024 财年
人工智能作为医疗器械监管格局
1. 根据国际医疗器械监管论坛(IMDRF)2. 诊断、预防、监测、治疗或缓解疾病或补偿伤害;研究、更换、修改或支持生理过程的解剖结构;支持或维持生命;控制受孕;医疗器械消毒;通过体外检查人体样本提供信息并且不能通过药理学、免疫学或代谢方式在人体内或体表实现其主要预期作用,但可能有助于实现其预期功能。
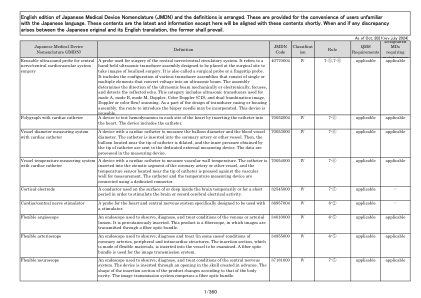
非关键医疗器械及信息管理...
目的:定义在提供护理和共享临床设备的临床区域中清洁和消毒非关键 IMIT 设备和非关键医疗设备的标准和要求。范围:所有岛屿医疗保健提供者,包括在临床和支持区域工作的医疗保健人员、医生、合同服务、志愿者和学生。范围内的设备:任何由单个工作人员使用的设备,从一个房间带到另一个房间但不接触患者;任何接触患者皮肤或患者环境的设备;任何患者之间共享的设备以及任何工作人员之间共享的设备。示例包括但不限于:vocera 徽章、药物配送车、移动工作站 (WOW)、键盘、电脑屏幕、条形码扫描仪、平板电脑、笔记本电脑、手机、个人设备、便携式生命体征监测仪、血氧仪和膀胱扫描仪。结果:减少工作人员、患者和环境互动中潜在的直接和间接微生物传播。所有用户组将积极将传播风险评估纳入日常工作流程和患者互动中,以确定并执行适当的清洁和消毒方案。
问卷调查 医疗器械中的人工智能
本文件应在医疗器械法规 (MDR;法规 (EU) 2017/745) 和体外诊断法规 (IVDR;法规 (EU) 2017/746) 以及 MDCG 关于医疗器械软件 (MDSW) 的指导的背景下理解。尚未考虑人工智能法规 (AI 法规 (EU) 2024/1689) 的具体要求。这些将成为全面修订的一部分,一旦欧洲标准可用,将进行全面修订(根据根据 2023 年 5 月 22 日欧洲委员会 C(2023)3215 的标准化要求)。需要注意的是,像 ISO/IEC 42001 人工智能管理系统或 ISO/IEC 23894 人工智能风险管理指南这样的全球标准不足以推定人工智能法规下的符合性,也不能被视为最先进的标准。然而,应该承认,人工智能法规中规定的要求与现有的医疗器械软件监管和标准框架有相当大的重叠。
日本医疗器械术语表英文版...
用于中枢神经/中枢循环系统手术的探头。它是指设计用于放置在手术部位以拍摄局部手术图像的手持式超声换能器组件。它也被称为手术探头或指尖探头。它包括由将电压转换为超声波束的单个或多个元件组成的各种换能器组件的配置。该组件以机械或电子方式确定超声波束的方向、聚焦并检测反射回波。此类别包括用于模式 A、模式 B、模式 M、多普勒、彩色多普勒 (CD) 和双 (组合图像、多普勒或彩色血流) 扫描的超声换能器。作为换能器外壳或外壳组件设计的一部分,可以纳入引入活检针的路线。该设备可重复使用。
医疗器械网络安全原则与实践
随着无线、互联网和网络连接设备的使用日益增多,对确保医疗设备功能和安全的有效网络安全的需求变得越来越重要。网络安全事件导致医疗设备和医院网络无法运行,扰乱了整个医疗机构的患者护理。此类事件可能因诊断和/或治疗干预的延误和/或错误等导致患者受到伤害。医疗保健部门的利益相关者对医疗设备网络安全负有共同责任。本指南旨在帮助所有利益相关者更好地了解他们在支持主动网络安全方面的作用,这有助于保护和确保医疗设备的安全,以防未来的攻击、问题或事件。全球医疗保健网络安全原则和实践的融合对于确保患者安全和医疗设备性能的维持是必要的。然而,到目前为止,各国政府目前不同的法规缺乏确保医疗设备网络安全所需的全球协调。本 IMDRF 指导文件的目的是提供一般原则和最佳实践,以促进医疗设备网络安全的国际监管融合。该文件的结构如下:第 2 节定义了该文件的范围,第 3 节定义了术语。第 4 节概述了医疗器械的一般原则
医疗器械制造和支持服务 - ...
本文所含信息被认为是可靠的,但对其准确性、特定应用的适用性或将获得的结果不作任何形式的陈述、保证或担保。这些信息通常基于使用小型设备的实验室工作,并不一定表明最终产品的性能或可重复性。所介绍的配方可能未经稳定性测试,应仅用作建议的起点。由于商业上用于处理这些材料的方法、条件和设备各不相同,因此不保证或担保产品是否适用于所披露的应用。全面测试和最终产品性能是用户的责任。对于超出 Lubrizol Advanced Materials, Inc. 直接控制范围的任何材料的使用或处理,Lubrizol Advanced Materials, Inc. 不承担任何责任,客户承担所有风险和责任。卖方不作任何明示或暗示的保证,包括但不限于适销性和特定用途适用性的暗示保证。本文所含内容不应被视为未经专利所有者许可而实施任何专利发明的许可、建议或诱因。Lubrizol Advanced Materials, Inc. 是 Lubrizol Corporation 的全资子公司。