XiaoMi-AI文件搜索系统
World File Search Systemhomologous
针对同源重组成瘾肿瘤
与癌症易感性和肿瘤发生相关的 DDR 基因的发现迫使 NGS 面板扩展个性化方法,以超越 BRCAness(即 BRCA1/2 基因)的范畴。然而,仅仅试图扩展 DDR 基因面板也有局限性。首先,尚不清楚低频突变的 DDR 基因(甚至是变体)是否真的是肿瘤发生的驱动改变。不幸的是,在许多情况下,包括 BRCA1/2 突变肿瘤在内,在特定肿瘤类型中发现的突变频率可能与更常见的癌症驱动基因(例如 Kras 或 TP53 )相比非常低,因此很难判断这些事件是否在给定的患者群中经常被选择。根据传统癌症遗传学的中心法则,某种肿瘤类型的突变频率必须高于健康对照群体的预期 (7)。其他复杂层面包括这些 DDR 相关基因是否具有与 BRCA1/2 等已建立的 DDR 基因相同的致命弱点(也称为合成致死性),以及这些基因是否符合经典的肿瘤抑制规则,即需要在肿瘤中丢失第二个等位基因(例如杂合性缺失,LOH)(7)。因此,在许多 DDR 基因中,尚不清楚这些 DDR 缺陷基因是否具有预测治疗价值。基于这些问题,许多研究人员试图设计检测分子特征的检测方法,以识别具有缺陷 DDR 通路的肿瘤(即 HRD,见下文)。
使用同源-NCI在Frederick的基因工程
■摘要在过去的几年中,体内技术已经出现,由于其效率和简单性,可能有一天会取代标准的基因工程技术。可以在质粒上或直接通过同源重组从PCR产物或合成寡核苷酸的大肠杆菌染色体上制成。这是可能的,因为噬菌体编码的重组函数有效地将序列与同源性序列短至35至50个碱基对。这项称为重新组合的技术正在提供修改染色体基因和片段的新方法。本综述不仅描述了重新组合及其应用,而且总结了大肠杆菌中的同源重组以及同源重组的早期使用以修饰细菌染色体。最后,基于噬菌体介导的重组功能在复制叉时的前提,提出了特定的分子模型。
同源癌细胞膜的构造...
重量是药物毒性和副作用的敏感指数,还使用电子量表来监测裸鼠体重的变化。每3天称重裸小鼠,并绘制裸鼠重量变化的时间曲线。在上述治疗结束后,用麻醉对裸鼠进行安乐死,然后使用4%多甲醛的组织固定溶液将肿瘤,心脏,肝脏,脾脏,肺,肺和肾脏剥离并固定24小时。收集裸鼠的肿瘤和器官组织,并染色苏木精和曙红(H&E),以观察任何组织病理学变化。收集裸鼠的血液进行血液学和生化分析。使用丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)评估血清肝功能,而肾功能是通过
同源重组修复(HRR)的基因检测...
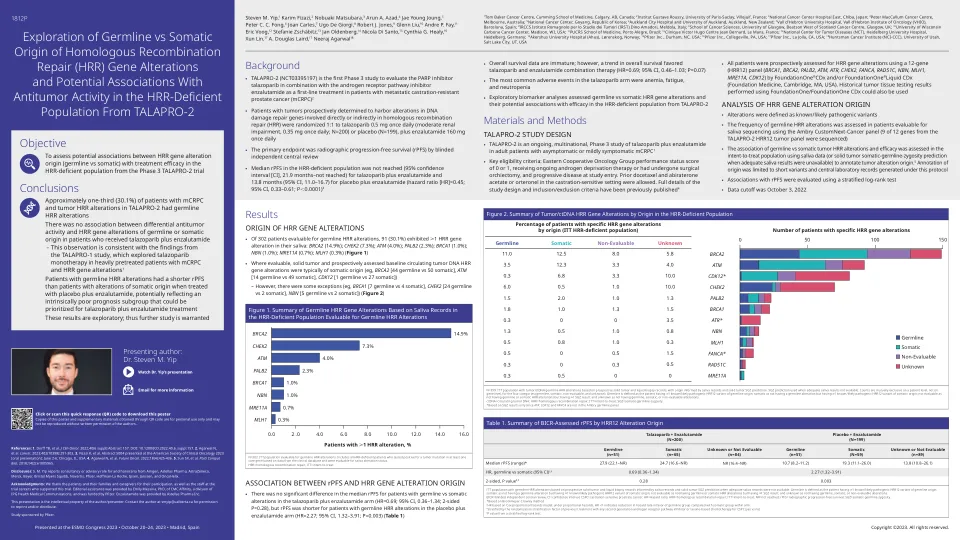
转移性去势抵抗性前列腺癌 (mCRPC) 患者的平均生存期仅为 13 个月。在多达四分之一的 mCRPC 患者中,同源重组修复 (HRR) 通路中发现了新的可预测和可操作的生物标志物,这促使多聚 ADP 核糖聚合酶抑制剂 (PARPi) 等靶向疗法获得批准,有可能改善生存结果。PARPi 的批准促使美国国家综合癌症网络 (NCCN) 等指导机构积极推荐进行种系和/或体细胞 HRR 基因组测试,以确定哪些患者将受益于 PARPi。然而,由于基因检测仍处于早期阶段,尤其是在低收入和中等收入国家,成本和可用性是主要障碍,因此存在一些挑战。此外,还存在一些问题,例如选择最佳组织进行基因检测、存档、储存、检索组织块、解释和分类 HRR 通路中的变异,以及测试前和测试后的遗传咨询的必要性。本综述深入分析了 mCRPC 中普遍存在的 HRR 基因突变以及更广泛的基因检测所面临的挑战,以识别 HRR 通路中可操作的种系致病变异和体细胞突变,并提出了一种临床算法来提高基因检测过程的效率。
重新组合:使用同源重组的细菌基因工程
要进行重新组合,需要表达噬菌体重组系统的细菌菌株。噬菌体可以从其自己的启动子或异源调节启动子中表达。从其内源性噬菌体启动子中表达基因的基因赋予了紧密调控和坐标表达的优势,从而导致更高的重组频率。这是一个重要的优势,因为在许多情况下,高重组频率对于获得所需的重组至关重要。该单元的作者通常使用位于大肠杆菌染色体上的有缺陷的预言,最近将该预言的关键要素转移到了许多不同的质粒中(Thomason等,2005;另请参见评论)。在此预言系统中,噬菌体重组功能受到肉毒噬菌温度敏感的C I 857抑制剂的控制。在低温(30至34 C)下,重组基因会严重抑制,但是当细菌培养的温度转移到42 C时,它们会从P L启动子中高水平表达。在Datsenko和Wanner(2000)的质粒构建体中,重组基因位于质粒上,并从阿拉伯糖启动子表示。DATSENKO和WANNER质粒以及某些作者的质粒构建体具有DNA复制的温度敏感性。基于质粒的系统具有迁移率的优势 - 它们可以在不同的大肠杆菌菌株中转移到鼠伤寒沙门氏菌和其他革兰氏阴性细菌。但是,如果重新组合针对质量,则使用位于细菌染色体上的预言系统更容易。在诱导重组函数后,将修饰的DNA(DS)(DS)PCR产物或合成单链(SS)寡核苷酸(Oligo)引入到预防菌株中,通过电穿孔引入预防菌株中。通过选择或筛选存活电穿孔的细胞种群获得重新组件。一旦获得了所需的构建体,就可以通过另一个重组去除预言。或者,染色体上的工程等位基因可以通过P1转导将不同的宿主移动到另一个宿主中。具有温度敏感复制起源的质粒可能会因在适当温度下的生长而从重组菌株中丢失。
古细菌DNA-Import仪器与细菌共轭机械同源
结合是水平基因转移的主要机制,促进了抗生素耐药性在人类病原体中的传播。它涉及通过称为交配菌毛的细胞外附属物来避免供体和受体细胞之间的连接。在细菌中,结合机制由质粒或转座子编码,通常介导同源移动遗传元件的转移。对古细菌的共轭知之甚少。在这里,我们通过三个共轭pili的冷冻电子显微镜确定原子结构,两种来自高疗法古细菌(Aeropyrum pernix和pyrobaculum calidifontis),另一个由一个由细菌的细菌ti toumefaciial to to to to to to to to to to to to to to toumefacial-to to to to to to to to to to toumefiti。 pili。然而,古细菌共轭机制(称为CED)已被“驯化”,即结合机械的基因编码在染色体上,而不是在移动遗传元素上,并介导细胞DNA的转移。
探索种系与同源重组的躯体起源
1汤姆·贝克癌症中心,卡明医学院,加拿大卡尔加里; 2法国维勒维夫大学,巴黎 - 萨克莱大学的Gustave Roussy研究所;日本千叶北部国家癌症中心医院3;澳大利亚墨尔本市彼得·麦卡伦(Peter MacCallum Cancer Center)4; 5号国家癌症中心,大韩民国戈阳; 6奥克兰市医院和奥克兰大学,新西兰奥克兰;西班牙巴塞罗那市Vall d'Hebron肿瘤学研究所(VHIO)Vall D'Hebron大学医院7; 8 Irccs iStituto romagnolo per lo Studio dei tumori(Irst)Dino Amadori,意大利梅尔多拉; 9英国格拉斯哥的苏格兰癌症中心的Beatson,格拉斯哥大学癌症科学学院9;威斯康星州麦迪逊市威斯康星州麦迪逊市威斯康星大学10号; 11 PUCRS医学院,巴西Porto Alegre; 12 Clinique Victor Hugo Center Jean Bernard,法国勒芒; 13德国海德堡海德堡大学医院国家肿瘤疾病中心(NCT);挪威洛伦斯科格(Lørenskog)14 Akershus大学医院(Ahus); 15美国北卡罗来纳州达勒姆市Pfizer Inc.; 16美国宾夕法尼亚州大学维尔市Pfizer Inc.; 17 Pfizer Inc.,美国加利福尼亚州拉霍亚; 18犹他大学,犹他州盐湖城,美国犹他州,亨斯曼癌症研究所(NCI-CCC)
表达异源重组酶的植物中同源重组的刺激
背景:CRISPR/Cas 和 TALEN 技术的进步激发了人们对植物基因编辑机会的兴奋。CRISPR/Cas 被广泛用于通过诱导靶向双链断裂 (DSB) 来敲除或修改基因,而双链断裂主要通过易出错的非同源末端连接或微同源介导的末端连接进行修复,从而导致可能改变或消除基因功能的突变。尽管此类突变是随机的,但它们发生的频率足以使有用的突变能够通过筛选定期识别。相比之下,用替代等位基因或具有特定特征修饰的拷贝替换整个基因的基因敲入目前还不常见。通过同源定向修复进行基因替换(或基因靶向)在高等植物中发生的频率极低,使得筛选有用事件变得不可行。通过抑制非同源末端连接和/或刺激同源重组 (HR) 可以增加同源定向修复。在这里,我们通过评估多种异源重组酶表达对烟草植物染色体内同源重组 (ICR) 的影响,为提高基因置换效率铺平了道路。结果:我们在含有高度敏感的 β -葡糖醛酸酶 (GUS) 型 ICR 底物的烟草转基因系中以不同的组合表达了几种细菌和人类重组酶。使用病毒 2A 翻译重编码系统实现了多种重组酶的协调同时表达。我们发现大多数重组酶在花粉中显著增加了 ICR,其中 HR 将由减数分裂期间发生的程序化 DSB 促进。DMC1 表达在初级转化体中产生了对 ICR 的最大刺激,其中一种植物的 ICR 频率增加了 1000 倍。对纯合 T2 植物系中的 ICR 的评估表明,ICR 增加了 2 倍到 380 倍,具体取决于表达的重组酶。相比之下,营养组织中的 ICR 仅适度增加,异源重组酶的组成性表达也降低了植物的育性。结论:异源重组酶的表达可以大大增加植物生殖组织中 HR 的频率。将此类重组酶表达与使用 CRISPR/Cas9 诱导 DSB 相结合可能是从根本上提高植物基因替换效率的途径。
CRISPR/CAS通过同源重组的第3章基因组编辑
在整个细胞发育中,DNA可能遭受威胁基因组完整性和细胞存活的损害。最有害的病变之一是双链DNA断裂(DSB),因为它可能导致基因组信息的丢失。DSB可能自然发生在细胞代谢期间,也可能是由外部因素触发的(Deriano; Roth,2013)。无论哪种方式,这些损坏都会通过细胞立即修复,主要是通过两种途径:非同源末端连接(NHEJ)或同源指导修复(HDR)。与通过NHEJ进行修复不同,NHEJ仅将裂解的DNA的末端连接起来(请参阅第2章),HDR途径需要存在相同或非常相似的模板,即完整的序列,以准确地修复病变的DNA(Heyer等人,2010年)。提供用于HDR中使用的模板的可能性代表了通过同源重组(HR)途径进行基因编辑的关键元素,该途径可能被利用为几种新的繁殖技术(NBT)之一。
将核酸外切酶与 Cas9 融合可增强毕赤酵母中的同源重组
HR 比 NHEJ 慢得多,NHEJ 可以从 DSB 事件中拯救更多细胞。NHEJ 几乎不需要或根本不需要末端切除来直接重新连接 DSB 末端。相比之下,HR 需要短距离切除和长距离切除 DSB 以及供体来实施修复过程。此外,其他蛋白质也可能是 HR 修复途径的限制因素 [18, 19]。我们在此发现,在同时删除两个基因和整合多个片段期间,将 MRE11 与 CAS9 融合可提高 CFU 数量