XiaoMi-AI文件搜索系统
World File Search Systempancreatic
感谢您强调获得胰腺酶的挑战。胰腺酶
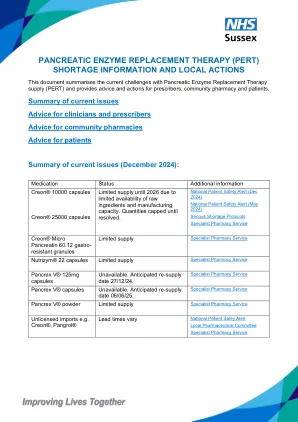
感谢您强调获得胰腺酶的挑战。胰腺酶的供应存在持续的欧洲范围问题。供应中断是由于有效的药物成分和制造限制的可用性有限,以产生满足需求所需的量。下面概述的行动与位置语句对齐:pert短缺|英国和爱尔兰胰腺协会(psgbi.org),总结了如何支持需要胰酶治疗的成年非囊性纤维化患者。当前情况Creon®10,000和25,000胶囊的供应量有限,直到2026年,Creon®10,000目前仅可从医院获得。Nutrizym22®和PancrexV®粉末可用,只应为无法忍受Creon的人开处方。请不要将人们从Creon更改为这些替代方案,因为股票水平将无法应付需求增加。以下更多详细信息:针对包括处方者和药剂师在内的临床团队的行动:
人工智能与胰腺癌的早期检测
Barbara Kenner,博士,* Suresh T. Chari,医学博士,† David Kelsen,医学博士,‡ David S. Klimstra,医学博士,§ Stephen J. Pandol,医学博士,|| Michael Rosenthal,医学博士、博士,¶ Anil K. Rustgi,医学博士,# James A. Taylor,医学博士,** Adam Yala,工程硕士,††‡‡ Noura Abul-Husn,医学博士,博士,§§ Dana K. Andersen,医学博士,FACS,|||| David Bernstein,博士,¶¶ Søren Brunak,博士,## Marcia Irene Canto,医学博士,MHS,*** Yonina C. Eldar,博士,††† Elliot K. Fishman,医学博士,‡‡‡ Julie Fleshman,法学博士,MBA,§§§ Vay Liang W. Go,医学博士,|||||| Jane M. Holt,文学士,¶¶¶ Bruce Field,理学士,* Ann Goldberg,文学士,* William Hoos,工商管理硕士,### Christine Iacobuzio-Donahue,医学博士,哲学博士,**** Debiao Li,哲学博士,†††† Graham Lidgard,哲学博士,‡‡‡‡ Anirban Maitra,医学学士,§§§§ Lynn M. Matrisian,哲学博士,工商管理硕士,§§§ Sung Poblete,注册护士,哲学博士,||||||||| Laura Rothschild,工商管理硕士,* Chris Sander,哲学博士,¶¶¶¶ Lawrence H. Schwartz,医学博士,#### Uri Shalit,哲学博士,***** Sudhir Srivastava,哲学博士,公共卫生硕士,理学硕士,††††† 和 Brian Wolpin,医学博士,公共卫生硕士 ‡‡‡‡‡
胰腺癌通过TGF-β– ...
胰腺导管腺癌(PDAC)是一种致命疾病,由于诊断晚期而无法治愈,这使任何具有治疗性干预措施具有挑战性。大多数PDAC患者减轻了从头糖尿病,这会加剧其发病率和死亡率。PDAC如何触发糖尿病仍在展开。使用KRAS G12D驱动的PDAC的小鼠模型,该模型忠实地概述了人类疾病的进展,我们观察到β细胞的大量和选择性耗竭,很早就出现在癌性病变的阶段。从机械上讲,我们发现PDAC pRogres-sion期间TGFβ(TGF-β)信号传导增加导致β细胞质量通过凋亡侵蚀。通过TGF-β免疫中性化或遗传通过删除SMAD4或TGF-βII型受体(TβRII)在药理学上按下TGF-β信号传导,从而对PDAC驱动的β-Cell Depetion提供了实质性保护。从转化的角度来看,TGF-β信号传导的激活和β细胞的耗竭经常出现在人类PDAC中,为PDAC患者的糖尿病发病提供了一种机械解释,并进一步暗示新的糖尿病是PDAC的潜在预后标记。
胰酶替代疗法(PERT)短缺...
•不得没有任何pert。这可能导致低血糖,严重的肠症状,其他药物的吸收不良和体重减轻。•Creon®10000胶囊应保留给无法服用Creon®25000胶囊的人,例如儿童和无法吞下更大胶囊的人。•CREON®微胰腺60.12mg胶囊优先考虑儿童和无法打开Creon®25000胶囊的吞咽困难的儿童。•Nutrizym®22应优先考虑无法忍受Creon®的人。这不适合15岁以下的儿童。•应对接受肠内喂养管的患者优先考虑Pancrex®V粉末。在大多数情况下,这不是患者口服服用的合适产品。•确保PERT处方最多1个月。通常,对于成年人来说,这最多为500CREON®25000/Nutrizym®22胶囊。作为EPS处方的单个项目或为患者提供处方令牌。在患者需要之前发出重复处方 - 建议患者提前2周,以便填补处方时间。请确保GP练习处方管理团队意识到与通常的练习的偏差。不要发布日期处方,请使用药房文本框来解释为什么要提交早期处方。•建议开处方:
RAS-GTP抑制胰腺癌
urszula N. Palermo, Marie C. Hasselluhn, Amanda R. Decker-Farrell, Stephanie Chang, Lingyan Jiang, Xing Wei, Yu C. Yang, Ciara Helland, Haley Courtney, Yevgeniy Gindin, Karl Muonio, Ruiping Zhao, Samantha B. Kemp, Cynthia Clendenin, Rina Sor, William P. Vostrejs, Priya S.克鲁格,古兰经A. Timour Baslan,Channing J.der,Mallika Singh&Kenneth P. Olive
rfx3对于人类胰腺的发展和成熟至关重要
。cc-by-nc-nd 4.0国际许可证(未经同行评审证明)获得的是作者/资助者,他授予Biorxiv授予Biorxiv的许可,以永久显示预印本。它是制作
胰腺癌研究计划的思想发展...
启动PI“ IDEA Development Award”必须指导并与早期职业研究员(合作PI)合作,以促进其在胰腺癌研究中的职业发展。早期职业研究者必须符合II.C节中所述的特定资格标准,资格信息。启动PI将负责与申请提交相关的大多数管理任务。启动和伙伴PI每个都有不同的提交要求,如第二条第2节所述,申请提交的内容和形式;但是,两个PI都应为拟议的研究项目的开发做出重大贡献,包括项目叙述,工作声明(SOW)和其他必需的组件。如果建议进行资金,每个PI将被命名为接受者组织中的个人奖励。鼓励涉及融合科学伙伴关系的项目。
不具有 KRAS、TP53、CDKN2A 的胰腺腺癌
胰腺癌是一种发病率不断上升的胃肠道恶性肿瘤,5 年生存率不足 10% (1)。转移性疾病的中位生存期约为 6 个月。与低收入国家相比,发达国家的发病率最高,男性发病率仅略高于女性 (2)。2019 年,美国有 45,750 人死于胰腺腺癌 (1)。尽管胰腺癌是全球第十三大常见癌症,有 458,000 例病例,但它却是死亡率排名第七的癌症 (3)。由于胰腺癌早期扩散且早期无症状,因此通常在晚期才出现。此外,尽管近年来随着更有效的化疗方案的引入,化疗治疗和管理有所改善,但对放疗和化疗的抵抗力仍是死亡率增加的原因之一 (4-7)。因此,迫切需要在阐明胰腺分子致癌作用的基础上改进全身治疗,而这是过去几十年来基因组癌症研究的成果 (8)。
胰腺癌分子亚型的临床影响
胰腺导管腺癌是一种高度致命的恶性肿瘤,目前已成为全球第七大癌症死亡原因,死亡率在欧洲和北美最高。在过去 30 年中,5 年生存率有所提高(从 2.5% 上升到 10%),但与所有其他常见癌症类型相比,这一水平仍然非常低。基于可操作突变的晚期胰腺癌靶向疗法令人失望,只有 3-5% 的患者显示出哪怕是短暂的临床益处。然而,除了负责产生经典信号通路的基因突变之外,还存在分子多样性。胰腺癌几乎是唯一一种促进基质其他成分过量产生的癌症,从而形成复杂的肿瘤微环境,有助于肿瘤的发展、进展和对治疗的反应。还描述了各种转录亚型。最值得注意的是,Moffit、Collinson、Bailey、Puleo 和 Chan-Seng-Yue 的经典/胰腺祖细胞和准间充质/基底样/鳞状亚型特征之间存在很强的一致性,这些特征具有潜在的临床影响。通过激光捕获显微镜结合单细胞 RNA 测序对富集的上皮细胞群进行测序,揭示了胰腺癌的潜在基因组进化是同一肿瘤内混合基底样和经典细胞群的基因表达连续性的结果,与突变型 KRAS 中的等位基因失衡有关,转移性肿瘤的拷贝数不稳定程度低于原发性肿瘤。与经典亚型相比,基底样亚型似乎更具化学抗性,生存率较低。化疗和/或放化疗也会丰富基底样亚型。与经典程序相比,鳞状/基底样程序促进免疫浸润。与基底和经典类型细胞相关的免疫浸润是不同的,可能为差异化策略打开大门。单细胞和空间转录组学现在将允许对肿瘤和驻留细胞进行单细胞分析
胰腺导管腺癌的自噬治疗靶向
1 美国罗德岛州普罗维登斯市布朗大学沃伦·阿尔珀特医学院转化肿瘤学和实验癌症治疗学实验室,2 美国罗德岛州普罗维登斯市 Lifespan Health System 和布朗大学医学系血液学/肿瘤学部,3 美国罗德岛州普罗维登斯市 Lifespan Health System 和布朗大学癌症生物学联合项目,4 美国罗德岛州普罗维登斯市布朗大学癌症中心,5 美国宾夕法尼亚州费城天普大学刘易斯卡茨医学院,6 美国罗德岛州普罗维登斯市布朗大学沃伦·阿尔珀特医学院病理生物学研究生项目,7 美国罗德岛州普罗维登斯市布朗大学沃伦·阿尔珀特医学院外科系,8 美国罗德岛州普罗维登斯市布朗大学沃伦·阿尔珀特医学院病理学和实验室医学系