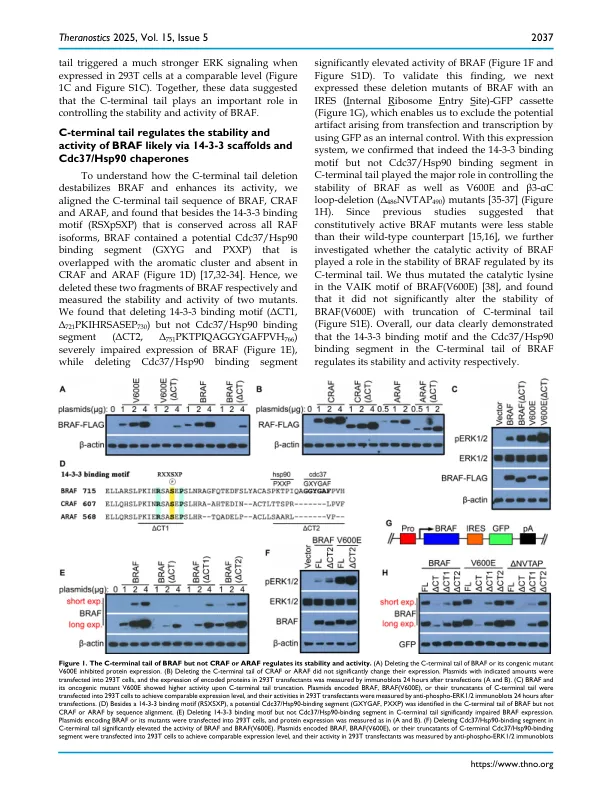
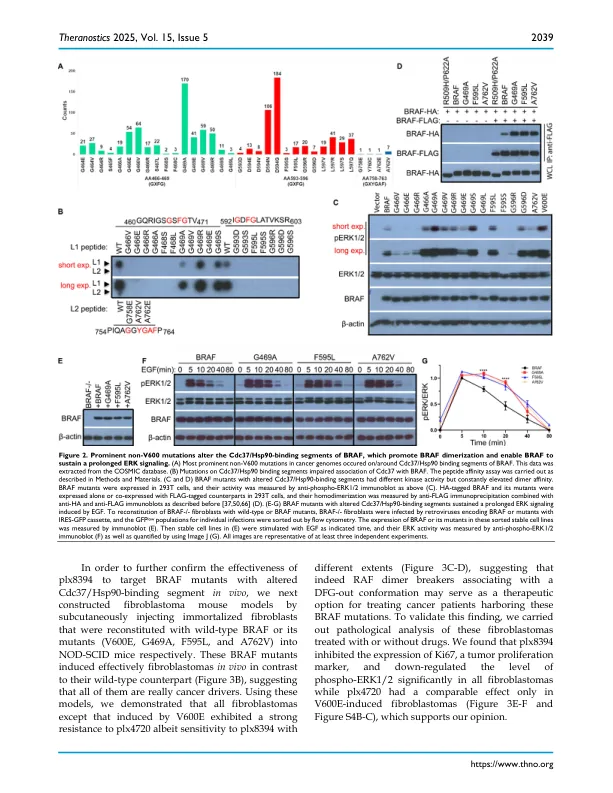
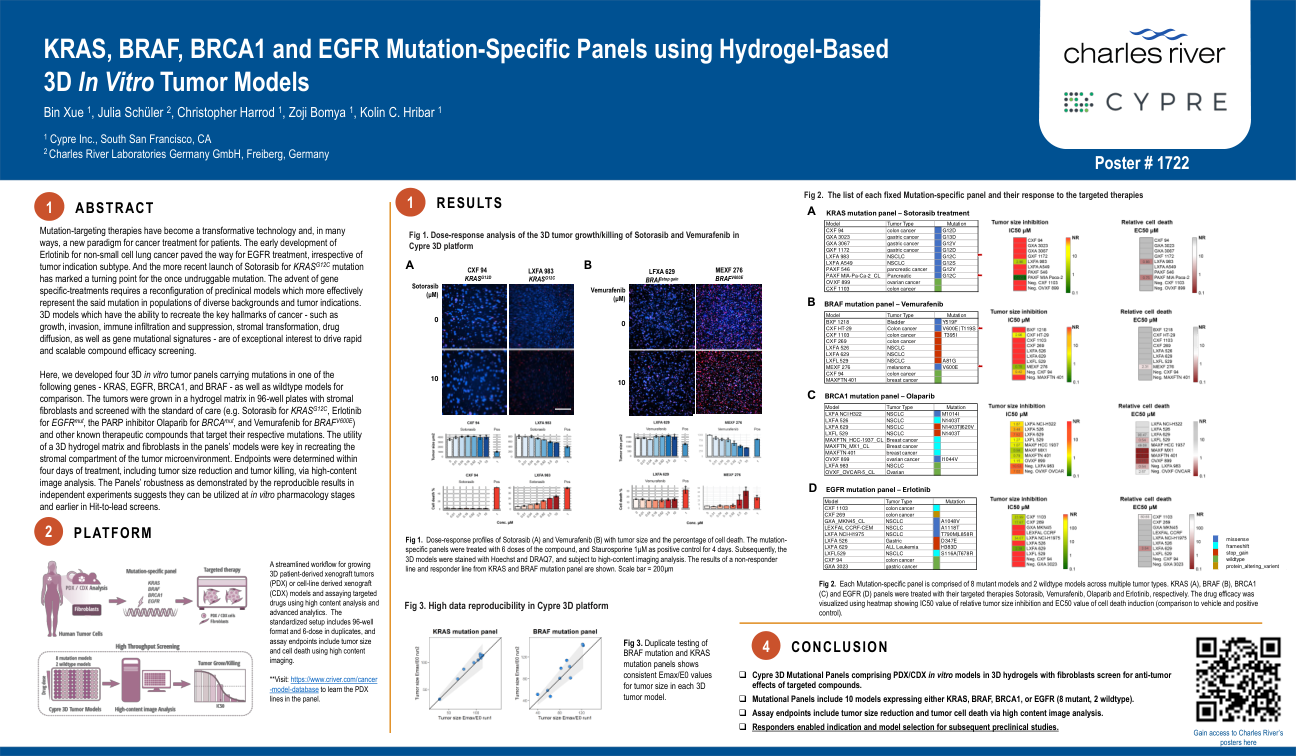
Ser/Thr 激酶 RAF,特别是 BRAF 亚型是致癌突变的主要靶点,在各种癌症中都发现了许多突变。然而,除 V600E 之外的这些突变如何逃避 RAF 蛋白的调节机制并因此引发其致癌性仍不清楚。方法:在本研究中,我们使用诱变、肽亲和力测定、免疫沉淀、免疫印迹和互补分裂荧光素酶测定以及小鼠异种移植肿瘤模型来研究 RAF 的功能如何由 Cdc37/Hsp90 分子伴侣和 14-3-3 支架协同调节,以及这种调节机制如何被普遍的非 V600 突变逃避。结果:我们发现 Cdc37/Hsp90 分子伴侣与成熟的 BRAF 蛋白结合,与 14-3-3 支架一起促进 BRAF 蛋白从活性开放二聚体转变为非活性封闭单体。大多数非 V600 突变富集在 BRAF 的 Cdc37/Hsp90 结合片段上或周围,这会削弱 CDc37/Hsp90 分子伴侣与 BRAF 的结合,从而使 BRAF 处于有利于二聚化的活性开放构象中。这些具有高二聚体倾向的 BRAF 突变体维持了长时间的 ERK 信号传导,并且在体外和体内被 RAF 二聚体破坏剂 plx8394 有效靶向。相反,CRAF 和 ARAF 以未成熟单体的形式存在,与 Cdc37/Hsp90 分子伴侣高度包装,在 RAS-GTP 与其 N 端结合以及 14-3-3 支架与其 C 端结合的驱动下,二聚化后释放。成熟的 CRAF 和 ARAF 二聚体也像非 V600 BRAF 突变体一样维持了长时间的 ERK 信号传导,这是由于缺乏 C 端 Cdc37/Hsp90 结合片段。结论:Cdc37/Hsp90 分子伴侣和 14-3-3 支架协同促进 RAF 蛋白从开放活性二聚体转变为封闭无活性单体。非 V600 突变会破坏这种调节机制,并将 RAF 困在二聚体中,而二聚体可能成为 RAF 二聚体破坏剂的目标。
治疗诊断学 致癌非V600突变逃避...