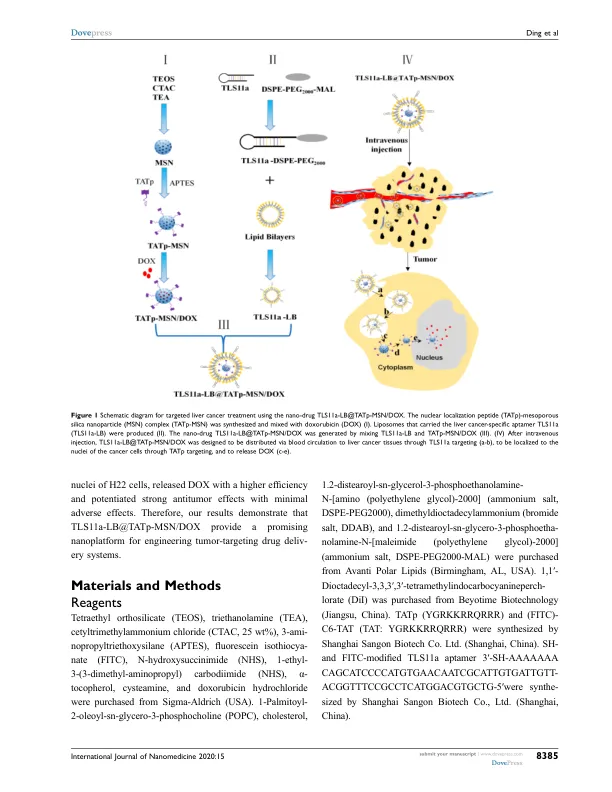
目的:癌症组织特异性和核定靶向药物的递送是化学疗法递送的理想选择。但是,它仅在体外研究中才实现,这主要是由于体内效率低。在这项研究中,我们旨在建立一个有效的双靶向系统,该系统针对肝癌组织以及体内癌细胞的核。方法:我们首先合成TAT肽(TATP) - 近极硅纳米颗粒(MSN)复合物(TATP-MSN),并产生的脂质体携带肝癌特异性Aptamer TLS11A(TLS11A-LB)。然后,我们通过混合TLS11A-LB和DOX负载的TATP-MSN来生成药物TLS11A-LB@TATP-MSN/doxorubicin(dox)。在纳米颗粒的物理和化学表征后,在pH 5.0和7.4中评估了从这些制剂中释放DOX。此外,我们还在体外评估了H22细胞中该药物的核定位和细胞毒性,并使用含H22肿瘤的小鼠模型研究了体内纳米毒的肝癌靶向和抗肿瘤活性。结果:使用透射电子显微镜(TEM)证实TLS11A-LB@TATP-MSN/DOX及其对照被确认为纳米药物(<100 nm)。TLS11A-LB@TATP-MSN/DOX的DOX释放速率在pH 5.0时明显快得高于pH 7.4。TLS11A-LB@TATP-MSN/DOX有效地针对H22细胞的核,并以比对照组更高的效率释放DOX。此外,TLS11A-LB@TATP-MSN /DOX表现出轻微的细胞毒性,但不明显超过对照组。因此,它是治疗肝癌的有希望的纳米药物。体内研究表明,TLS11A-LB@TATP-MSN在BALB/C小鼠的右腋下中积聚在皮下H22肿瘤中,分别在静脉注射后48小时达到峰值水平,并证明TLS11A-LB@TATP-MSN/DOX组在tls-lb@taTP-MSN/DOX组效应时效应有效。结论:TLS11A-LB@TATP-MSN/DOX可以通过双重靶向肝癌组织和小鼠中癌细胞的核有效地将DOX传递到肝癌细胞的核。关键字:靶向药物,肝癌治疗,基于MSN的车辆,阿霉素,组织和核特异性靶向
从全球健康的角度来看,需要抗病毒药物
主要关键词