机构名称:
¥ 1.0
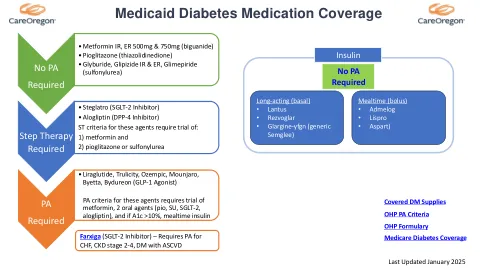
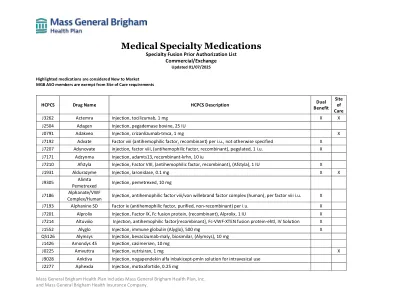
FDA 提议在广泛审查后停止使用口服去氧肾上腺素作为 OTC 专论鼻腔减充血剂活性成分 FDA 批准 REMS 修改,推进新药处置方案 FDA 批准一种新的治疗方法,用于治疗口服抗生素治疗选择有限或没有其他选择的女性无并发症尿路感染 FDA 批准一种治疗血友病 A 或 B 的新方法 FDA 批准一种治疗由转甲状腺素介导的淀粉样变性引起的心脏病的药物 Intercept Pharmaceuticals 的 Ocaliva(奥贝胆酸):药物安全通讯 - 在非肝硬化患者中观察到严重的肝损伤 FDA 增加警告,关于使用 Veozah(fezolinetant)治疗更年期引起的潮热时罕见发生严重肝损伤。如果出现肝损伤的体征和症状,请停止用药 - 药品安全通讯 FDA 建议更改用于治疗阿片类药物使用障碍的透粘膜丁丙诺啡产品的标签 11. 休会 *参加 DUR 委员会会议的个人将有机会向委员会发言。此机会将在会议的公开部分提供一次。为了照顾到所有相关方,请所有发言者将其评论时间限制在 5 分钟或更短。如果您作为雇员、承包商、制造商演讲局成员或以任何其他方式代表一家药品制造商,我们希望您在这 5 分钟的时间内介绍您的单个产品或整个产品线。代表多家制造商的发言者将与他们所谈论产品的其他制造商代表分享他们的 5 分钟时间。任何发言、演示或提供书面评论的个人都必须注册并完成利益冲突披露。必须在预定会议召开前至少一周向 DUR 工作人员提交注册信息和填妥的表格,邮箱地址为 pba_iadur@optum.com。如果未能在指定日期和时间之前注册并提交完整的利益冲突披露表,则您的意见将被延迟到下一次预定会议进行审议。
爱荷华州医疗补助药物使用审查 (DUR) 委员会
主要关键词