机构名称:
¥ 1.0
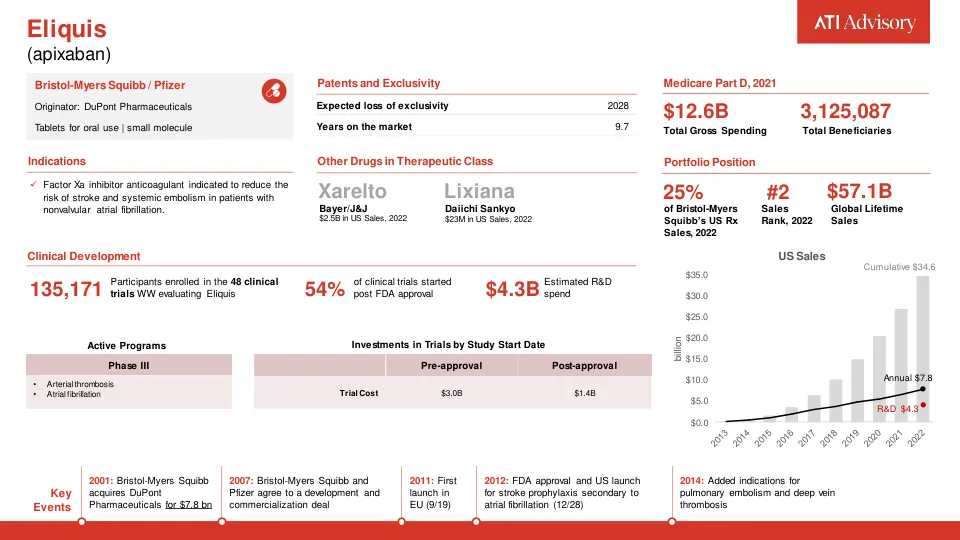
根据我们的估计,上市后研究对整体研发支出贡献巨大。平均而言,61% 的临床研究支出是在药物首次获得 FDA 批准后进行的。这些研究与获得 FDA 初步批准后进行的研究不同。上市后,公司通常会进行 III 期或 IV 期研究,这些研究的成本比早期阶段更高,招募的研究参与者也更多。它们的目的不是开发新药,而是促进现有药物的营销——满足 FDA 的上市后要求、增加新适应症或向付款人展示药物的价值(并非所有试验都是为了 FDA 的利益而进行的)。
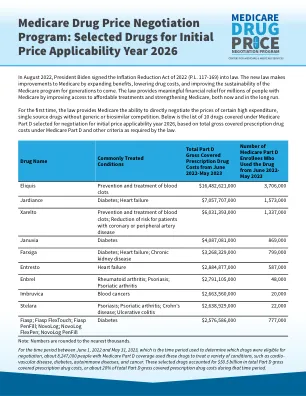
医保谈判的首批 10 种药物