机构名称:
¥ 1.0
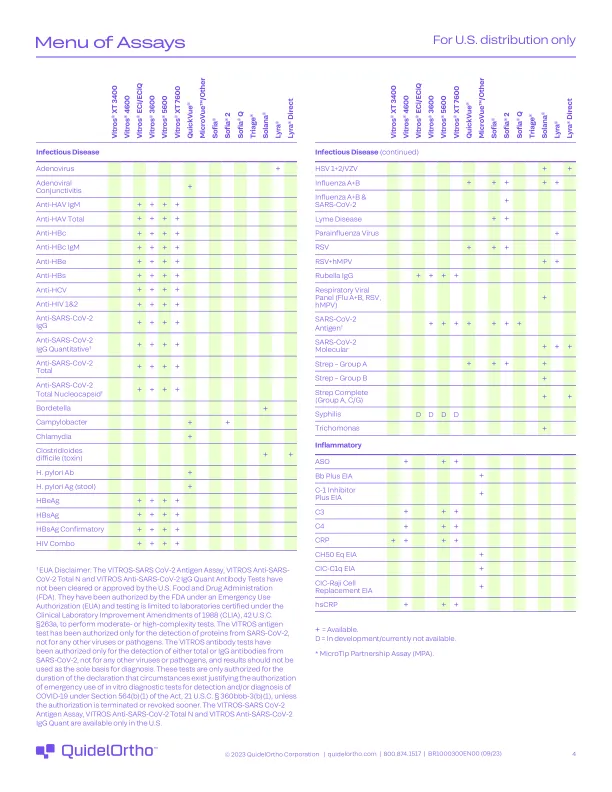
†EUA免责声明:Vitros-SARS COV-2抗原测定,Vitros抗SARS-COV-2总N和VITROS抗SARS-COV-2 IgG-2 IgG量子抗体测试尚未得到美国食品和药物管理(FDA)的批准。他们已由FDA根据紧急使用授权(EUA)授权,并且测试仅限于1988年临床实验室改进修正案(CLIA)的实验室,美国法典第42卷。§263A,进行中等或高复杂性测试。VITROS抗原试验仅用于检测SARS-COV-2的蛋白质,而不是用于任何其他病毒或病原体。VITROS抗体测试仅用于检测SARS-COV-2的总或IgG抗体,而不是用于任何其他病毒或病原体,因此不应将结果用作诊断的唯一基础。这些测试仅在声明的持续时间内被授权,即存在情况是合理的,证明了授权在第564(b)(1)条的第21条(美国法案)第564(b)(1)条所述的COVID-19的体外诊断测试中进行检测和/或诊断。§360BBB-3(b)(1),除非授权更早终止或撤销。Vitros-SARS COV-2抗原测定,Vitros抗SARS-COV-2总N和Vitros抗SARS-COV-2 IgG量仅在美国可用
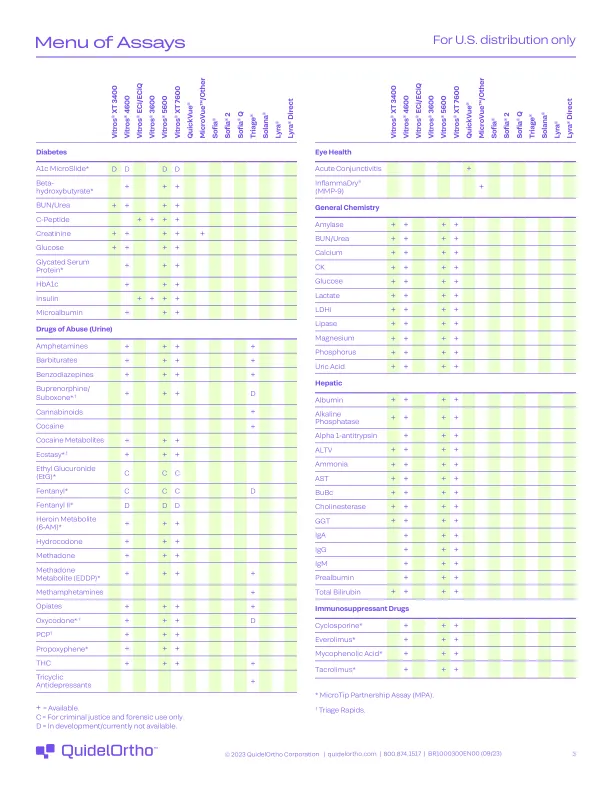
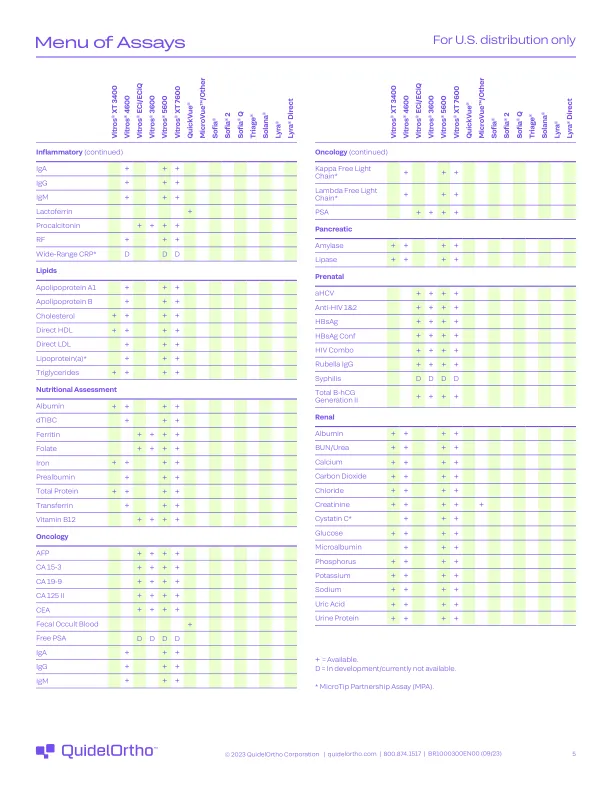
测定菜单
主要关键词