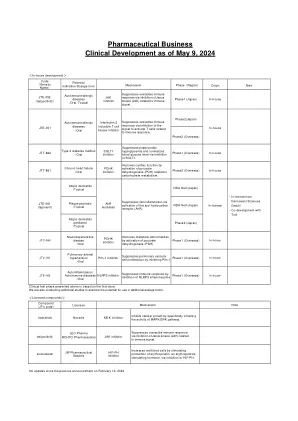
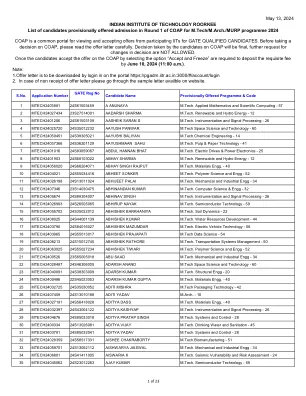
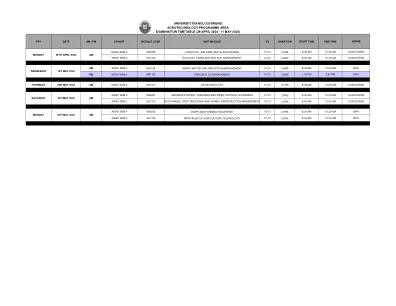
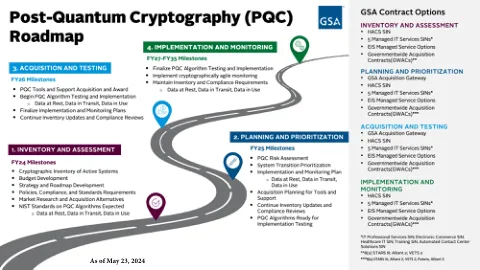
在批准时,先前治疗的小儿患者(EFC16295; NCT04759131)进行了关键的第三阶段研究,并进行了临时疗效和安全数据以进行审查。提交补充生物制剂申请(SBLA)提供了针对EFC16295研究的最终临床研究报告,以及第三阶段研究的合并手术和安全数据。由于BIVV001当前已被批准为儿科受试者,因此该提交为小儿研究提供了更新的功效和安全性数据,该研究已纳入标签中。完成的研究EFC16295是根据SBLA提交评估的主要研究。研究EFC16295是一项多中心,开放标签的研究,用于评估BIVV001治疗的PK,安全性和疗效,用于预防和治疗先前治疗的小儿受试者(<12岁)的出血。在儿科研究中总共有74名先前治疗的受试者中评估了BIVV001的安全性和功效,他们接受了至少一剂BIVV001。这包括另外51名进行分析的受试者,因为临时分析仅包括具有至少26周(n = 23 = 23周)的受试者。有74名受BIVV001治疗的受试者<12岁。七十三个治疗的疗效期限超过26周。七十二名受试者是可以评估的功效,并具有平均年化出血率(ABR)(95%CI)为2.6(1.6,4.0),ABR的中位数为0.5(0,2.1),为所有出血。最常见的AE是温和且短暂的上呼吸道感染和上级。未检测到抑制剂。与BIVV001给药前基线平均处理的ABR(标准偏差; SD)为2.1(4.2)和中位数为1.0(0; 32)相比,所处理的ABR为0.6(95%CI:0.4、0.9)和ABR(Q1,Q3)的中位数为0(0,1.0),为0(0,1.0)。小儿人群中没有发现新的安全信号。评估了两名需要两种主要手术程序的受试者的围手术期管理,并用BIVV001治疗了手术止血。用BIVV001治疗在两项主要手术中都提供了良好或出色的止血控制。由于孤儿的名称,此提交并未触发小儿研究权益法(PREA)。没有售后承诺或要求。
2024年5月7日临床审查备忘录-Altuviiio
主要关键词