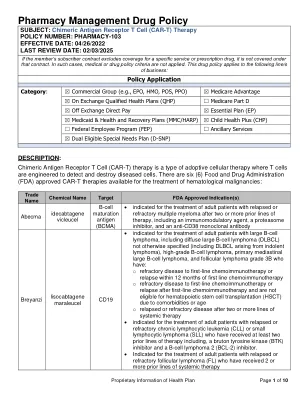
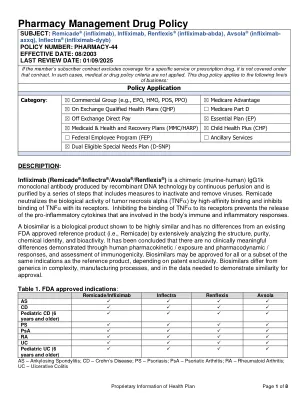
机构名称:
¥ 1.0
持续为患者带来益处,包括改善或稳定疾病状态或病情。除非另有规定(例如,需要提供者证明),否则必须为每项请求(初始和重新认证)提交临床文件。支持文件包括但不限于记录先前治疗/治疗历史的进度记录、诊断测试、实验室测试结果、基因测试/生物标志物结果、成像和其他客观或主观益处测量,这些测量支持继续使用请求的产品在医学上是必要的。此外,持续使用请求的产品必须继续反映当前政策的首选处方集。重新认证审查可能会导致要求在更具成本效益的治疗替代方案可用时尝试它们(即仿制药、生物仿制药或其他指南支持的治疗方案)。请求的剂量必须继续符合 FDA 批准或标签外/指南支持的剂量建议。6. 对于适用《保险法》第 4903(c-1) 条和《公共卫生法》第 4903(3-a) 条的合同,
药房管理药品政策