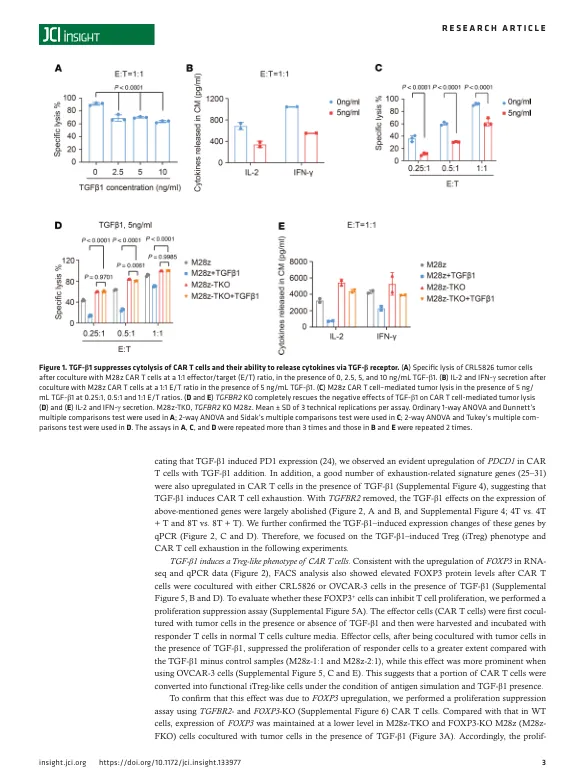
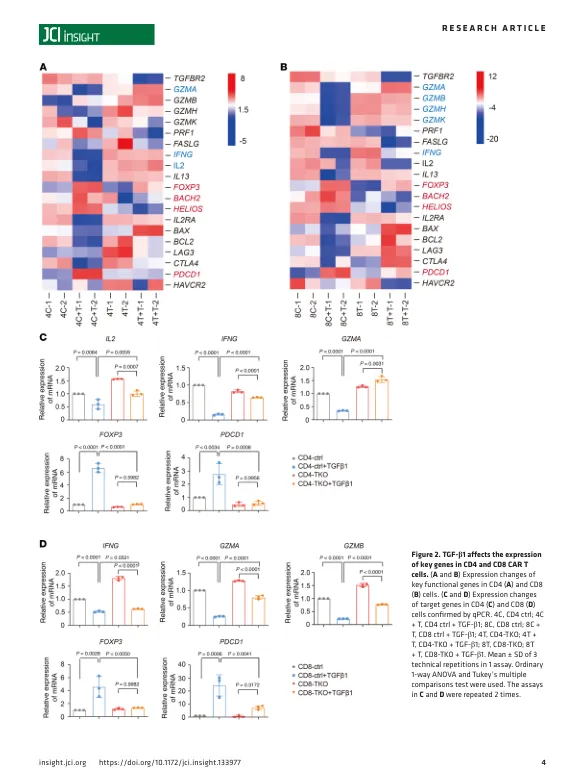
引言近年来,嵌合抗原受体修饰的T细胞(CAR-T细胞)已成为一类颇有前途的癌症治疗方法(1-3)。抗CD19 CAR-T细胞在治疗血液系统恶性肿瘤方面取得了显著的治疗效果,2017年FDA批准了两种产品(4,5)。然而,尽管经过多次尝试,针对各种肿瘤相关抗原的CAR-T细胞仍然无法以可重复的方式在实体瘤患者中产生良好的临床反应(2,6-8)。CAR-T细胞渗入实体瘤后面临的主要挑战之一是抑制性肿瘤微环境(TME)。实体瘤TME除了癌细胞外还包含多种细胞类型以及细胞外基质成分和炎症介质。在这种复杂的微环境中,T细胞会遇到许多抑制性细胞和分子,这些细胞和分子会损害其存活、活化、增殖和效应功能(9,10)。 TGF- β 是 TME 中最重要的调节剂之一,可由基质细胞分泌,例如癌症相关成纤维细胞、血液内皮细胞、间充质干细胞、淋巴上皮细胞和周细胞 (9)。TGF- β 有 3 种配体:TGF- β 1、TGF- β 2 和 TGF- β 3。TGF- β 1 在肿瘤细胞和 TME 中上调最为常见 (11, 12)。TGF- β 配体通过 I 型和 II 型 TGF- β 受体(分别为 TGF- β RI 和 TGF- β RII)发出信号。与 TGF- β RII 结合后,TGF- β RI 被募集、磷酸化和激活,从而磷酸化下游介质,然后调节基因转录 (13, 14)。 TGF-β在肿瘤发生发展中起着非常重要的作用。同时,TGF-β对抗肿瘤免疫有不利影响,并显著抑制宿主的肿瘤免疫监视(12,15)。据报道,TGF-β通过转录下调编码关键蛋白(如穿孔素、颗粒酶和细胞毒素)的基因,显著抑制CD8+T细胞的细胞毒功能(16,17)。TGF-β通过诱导Treg转化来影响CD4+T细胞的分化和功能(17,18)。此外,抑制
通过 CRISPR 抑制 TGF-β 可促进长期疗效......
主要关键词