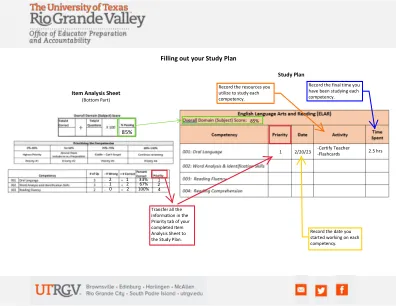
机构名称:
¥ 2.0
本指南不包含根据《儿科研究公平法案》(PREA)或《最佳儿童药物法案》(BPCA)对儿科用药开发的一般要求的讨论。3 一般而言,FDA 的指南文件不规定具有法律强制执行力的责任。相反,指南描述了该机构当前对某一主题的想法,除非引用具体的监管或法定要求,否则应仅将其视为建议。机构指南中的“应该”一词意味着建议或推荐某事,但不要求这样做。II. 背景 在过去 20 年里,FDA 一直致力于解决对儿科人群的药物测试不足以及药品标签中儿科使用信息不足的问题。1994 年,FDA 发布了一项最终规则,要求上市药品的制造商调查现有数据并确定这些数据是否足以支持在药品标签中添加儿科使用信息。 4 但是,1994 年的规则并没有规定制造商在现有信息不足以支持增加儿科用药信息时必须进行研究的一般要求。最初鼓励申办方提交儿科研究和计划以充分告知儿科患者用药的尝试未能成功实现大多数药物在儿科亚群中的充分使用标签,并且产品标签经常未能提供在儿科患者中安全有效使用的说明。为了解决这一持续存在的问题,1997 年《食品和药物管理局现代化法案》5 获得通过,其中包含了激励措施,鼓励对具有独占权或专利保护的药物进行儿科研究。此外,1998 年 12 月 2 日,FDA 发布了一项称为儿科规则的法规。6 该规则部分解决了缺乏儿科用药信息的问题,要求某些新药和上市药物的制造商进行研究,以提供足够的数据和信息来支持针对所声称的适应症的儿科用药说明。这项儿科规则还规定,FDA 将向申办方提供其最佳判断,以确定是否需要进行儿科研究,以及是否应将其提交推迟到批准后。这一意见
儿科学习计划:
主要关键词