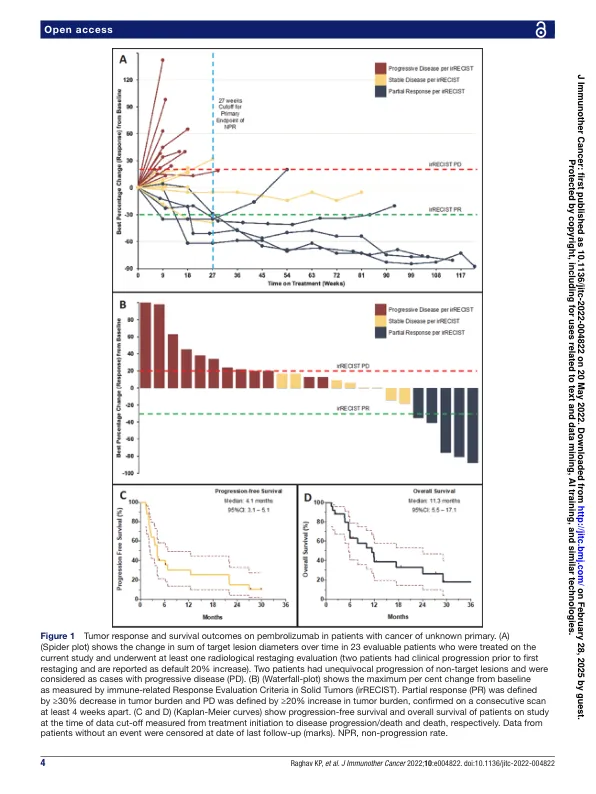
未知初级(杯)的抽象背景癌是一种具有少有治疗选择的攻击性罕见恶性肿瘤。缺乏有关杯赛中免疫检查点抑制剂的临床活性的数据。因此,我们评估了pembrolizumab(一种程序性细胞死亡-1抑制剂)对杯赛患者的疗效。方法该研究被设计为2期篮子试验,用于包括杯子在内的独立稀有肿瘤队列。在先前的全身治疗,性能状态0/1和可测量疾病中,实体瘤中的cup患者(recist v.1.1)符合条件。患者每21天静脉内接受pembrolizumab(200 mg)。29例患者在2016年8月至2020年6月之间接受了治疗。主要终点是每次免疫相关的再生27周(NPR-27)的非促进率(NPR)。键预先指定的二级终点已确认客观响应率(ORR),安全性,响应持续时间(DOR),无进展生存期(PFS)和总生存期(OS)。对反应的生物标志物检查(程序性细胞死亡配体1(PD-L1)表达和肿瘤浸润淋巴细胞(TILS))。在25例(有29名纳入)符合条件和可评估患者的结果中,有14名(56%)分化较差。患者在入学前接受了两条治疗的中位数。中位随访时间为27.3个月。NPR-27(28.0%(95%CI:12.1至49.4))。中位PFS和OS分别为4.1(95%CI:3.1至5.1)和11.3(95%CI:5.5至17.1)月。ORR为20.0%(95%CI:6.8至40.7),五名患者在14.7个月(95%CI:9.8至19.6)中获得了与免疫相关的部分反应。分别在19例(76%)和4(16%)患者中看到与治疗相关的不良事件和≥3级。一名(4%)患者患有3级免疫相关的急性肾脏损伤,需要停用治疗。PD-L1和TIL都不与NPR-27相关。阳性PD-L1染色(44.4%vs 6.3%; P = 0.040)和强烈的TIL浸润(44.4%vs 6.3%; P = 0.040)均与响应有关。pembrolizumab结论显示出可接受安全性cup的患者的疗效。试用注册号NCT02721732。
第2阶段非随机临床试验
主要关键词