机构名称:
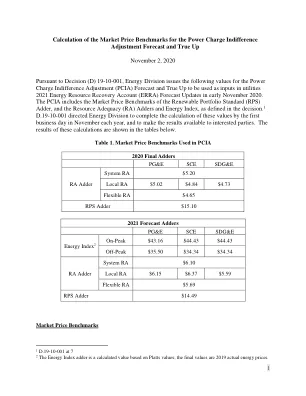
¥ 5.0
该指南,与调节(EU)2017/746在体外诊断医疗设备(IVDR)上的应用有关,涉及对体外诊断医疗设备(IVD)的分类,并对附件VIII下的分类规则提供了澄清。此分类指南还适用于对欧盟患者或通过远程销售服务的欧盟患者或设备进行的诊断或信息社会服务。该指南是由代表成员国主管当局,委员会服务,通知机构和行业的专家组制定的。本指南还考虑了2019年12月27日在欧盟官方杂志上发表的Crigendum。由于本文档旨在提供有用的信息以确保相关监管条款的统一应用,因此应始终与IVDR一起阅读。本文档的主要目的是向制造商,通知机构和卫生机构提供有关如何在将其放置在市场之前对IVD进行分类的指导,在市场上可用或在工会中投入使用。在评估制造商或卫生机构归因于IVD的类时,它还旨在告知监管机构和其他利益相关者。重要的是要回想起IVDR为IVD的分类规定了法律授权。本文档中的示例仅用于说明目的,并不代表详尽的列表。因此,仅应成员国的要求,或者根据其主动性,委员会应在咨询医疗设备协调小组(MDCG)之后,通过实施ACNENX VIII在给定设备上应用,或类别或类别的设备,以确定此类设备的分类(47(3-47(3-4))的分类,该委员会应通过实施ACNEN VIII应用于给定设备,或类别或类别的设备来决定。在解决分歧解释和实际应用的必要范围内,委员会可以采用实施行为,以确保分类规则的统一应用,并考虑到相关科学委员会的相关科学意见(IVDR的第47(5)条)。
MDCG 2020-16 Rev.3-关于...
主要关键词