机构名称:
¥ 1.0
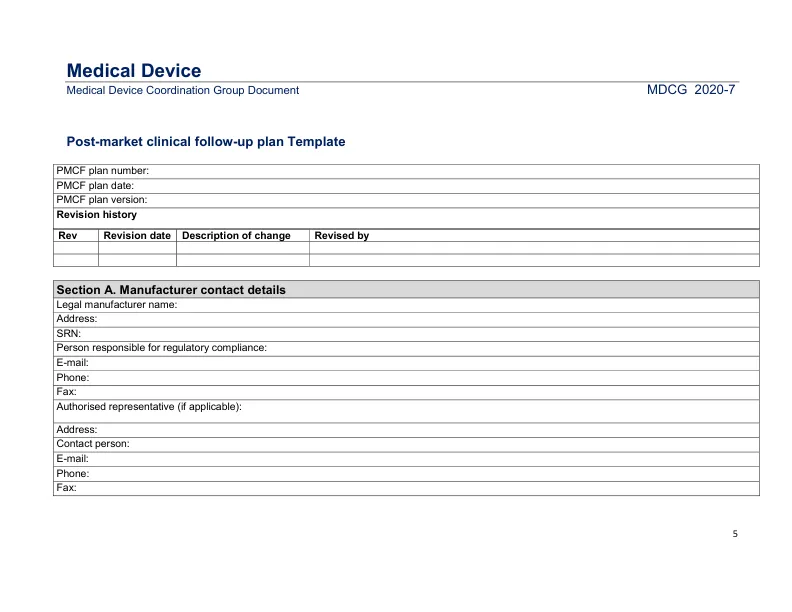
确认器械在预期使用寿命内的安全性 1 和性能,包括临床益处(如适用); 识别先前未知的副作用并监测已识别的副作用和禁忌症; 根据事实证据识别和分析新出现的风险; 确保 MDR 附件 I 第 1 节和第 9 节中提到的效益风险比的持续可接受性; 识别器械可能的系统性滥用或标签外使用,以验证预期用途是否正确。 PMCF 计划应为上市后监督计划的一部分。制造商应分析 PMCF 的结果,并将结果记录在 PMCF 评估报告中。PMCF 评估报告应为临床评估报告和技术文件的一部分。PMCF 计划及其应用的充分性须经公告机构评估。公告机构对临床评估的评估还应涵盖制造商的 PMCF 程序和文件,以及与未履行 PMCF 相关的辩解。本模板的目的是指导制造商遵守 MDR 关于编制 PMCF 计划的要求。这将有助于制造商以统一和完整的方式呈现上市后临床数据,并促进公告机构和主管当局以有组织的格式查找信息。
MDCG 2020-7 - 公共卫生 - 欧盟委员会
主要关键词