机构名称:
¥ 1.0
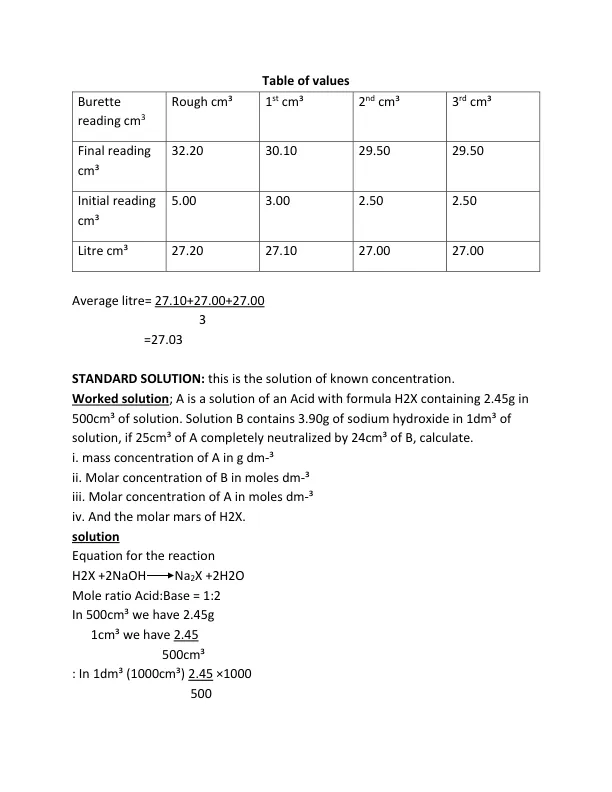
影响溶解度的因素1。溶质的性质 - 离子比溶剂2。溶剂的性质 - 离子更可溶于极性水比非极性溶剂。3。温度变化,KNO 3,KCLO 3,AGNO 3,NANO 3在溶解水时吸收热量(Ca(OH)2释放在水中时。通过过滤确定物质的溶解度。溶质在特定温度下饱和溶剂的最大量的溶解度,在特定温度下以摩尔每dm³进行测量,因此,如果溶液是砂的溶液并用标准溶液与标准溶液中的过滤相关,则每个DM³的摩尔浓度也是溶解度。工作;溶液A为0.09摩尔HCl,通过在25°C下取25厘米的Na 2 Co 3的标准溶液获得溶液B,并用蒸馏水将其稀释至100厘米。25厘米的B完全用24.90厘米的A甲基橙作为指示。计算i。溶液B的浓度B在DM³II中的摩尔中。Na 2 Co 3在25°C下的溶解度,每dm³III。通过将饱和溶液的1dm³蒸发至干燥度获得的Na 2 Co 3的质量。解决方案;反应2HCl + Na 2 CO 3 2 NaCl + H 2 0 + CO 2摩尔比的等式:碱= 2:1 cava = Na Cbcb Nb cb = Cava NB VBNB CB = 0.090×0.02490×0.02490×1 0.025×2 = 0.0405moldm-- = 0.0405moldm-in = 0.0405moldm-ins v1 morc. 25c 25c 25c 25c 25c 25c 25c 25c 25c 25c 25c 25c 25c 25c 25c 25c 25c 25c 25c 25c 25c 25c 25cin of v1 mor v1 mor v1 mor v1 0.045molfm-³c1v1= C2V2
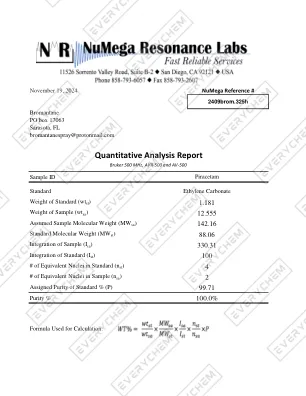
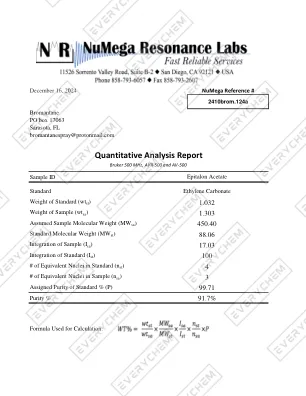
定量分析
主要关键词