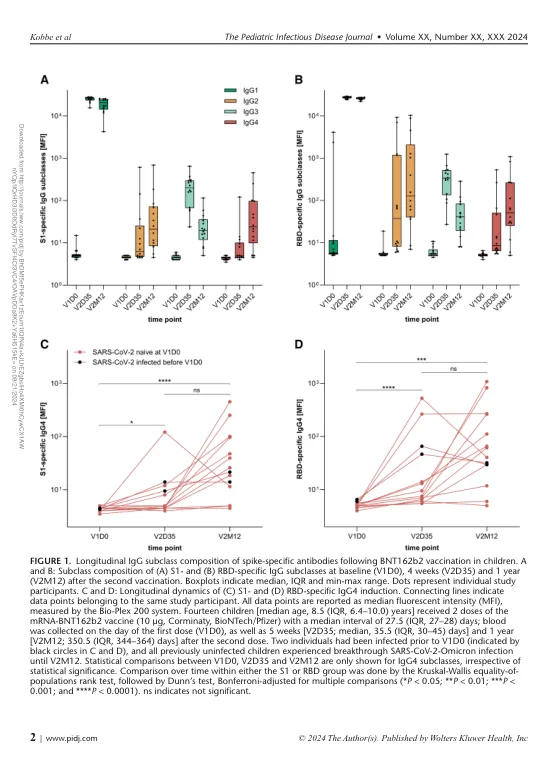
demic,允许安全有效的大规模疫苗接种,挽救了数百万的生命,并开放了开发广泛的未来治疗剂的可能性。1最近对重复的mRNA疫苗接种后,SARS-COV-2特异性抗体与针对COVID-19的保护以及对COVID-19的保护以及有关体液免疫反应收集的详细知识的牢固关联。2同时,MRNA疫苗接种引起的某些特征仍需要进一步研究,其中包括免疫球蛋白(IG)G4抗体的异常诱导。通常,2剂BNT162B2或mRNA-1273后的保护性体液反应主要由IgG1和IgG3亚阶级抗体组成,这些抗体能够通过抗体依赖性细胞毒性,吞噬剂,phagocytosis和smpligection interiation(FC)构造抗体依赖性细胞毒性依赖性依赖性细胞毒性依赖性依赖性的抗体依赖性依赖性的抗体功能(FC)。2,3小鼠中的现实数据以及被动和主动的免疫研究表明,FC区域与FC Gamma受体的参与是疫苗诱导的抗体介导的抗体介导的保护抗抗原上不同的SARS-COV-2变体,包括OMICRON株,包括Omicron Strains。3,4之前,据报道,与成人相比,在第二次疫苗接种后的2-4周,接种疫苗剂量(BNT162B2,10 µg)接种了3倍低的疫苗剂量(BNT162B2,10 µg)的儿童。5在同一项研究中,Luminex对FC受体 - 结合特性的分析表明,与成人相比,儿童在FC受体受体结合的抗体中安装了模拟水平。这一发现表明,在这个年轻的年龄组中,质量上较高的FC抗体功能可能有助于保护Covid-19的变体和衰减。5 Irrgang等6是第一个报告成人SARS-COV-2峰值特异性IgG4比例增加的人,从第二个开始,并在第三次mRNA疫苗剂量后进一步增加,最高为总特异性IgG水平的19.27%。此外,他们观察到尖峰特异性抗体的能力降低了介导抗体依赖性细胞吞噬作用和补体沉积以及IgG4交换B细胞的大量频率的能力。在成年人中,这种mRNA特异性作用似乎在感染的个体中被提出。7在基于腺病毒病毒和修饰的VacInia病毒Ankara(MVA)基于SARS-COV-2疫苗的同源疫苗接种后,没有观察到这种情况,并且在较小程度上,在基于腺病毒和MVA的异源免疫后,基于腺病毒和MVA进行了mRNA的疫苗。8–10,这些研究还报道了非典型的IgG2抗体诱导,通常不是由蛋白质而不是蛋白质诱导,而是多糖抗原,并且对FC受体的亲和力较低。6,7,10 To determine IgG4 induction following BNT162b2 vaccination in children 5-11 years of age, we measured SARS-CoV-2 spike subunit 1 (S1)–specific and receptor-binding domain (RBD)–specific IgG sub- classes by a bead-based multiplex immunoassay in 14 healthy children [median age, 8.5 (interquartile range [IQR], 6.4–10.0)年; 6(43%)
延迟诱导非炎性SARS-COV-2 SPIKE
主要关键词