XiaoMi-AI文件搜索系统
World File Search System遗传病管理:现在和未来
如今,遗传病的数量约为 10,000 种,影响到所有人口的 6%-8%。本综述向我们展示了如何发现基因组中的遗传变异,这有助于准确了解病理生理机制,从而识别那些易于改变的目标点,通过不同于姑息治疗的治疗策略,延长预期寿命或改善生活质量。这些疗法多种多样,使用多基因疾病药物、营养疗法、特殊配方、酶替代疗法、造血干细胞移植、底物减少、寡核苷酸和基因疗法。这些遗传病在临床上是异质性的,发病率非常低;尽管如此,仍有可能研究更多遗传病的新策略,而且这些疾病如今还是孤儿病。
儿科遗传病的治疗:现在和未来......
有 7,000 多种儿科遗传病 (PGD),但只有不到 5% 有治疗选择。针对疾病生物过程的不同水平的治疗策略已经为可治疗的一部分 PGD 患者带来了最佳健康结果。在过去 30 年里,包括基因疗法在内的多种 PGD 新疗法的开发取得了迅速进展。治疗的成功在很大程度上依赖于对遗传基础和疾病机制的了解。具体而言,基因疗法已在各种临床试验中被证明是有效的,事实上,这些试验已经获得监管部门的批准,为其他类型 PGD 的基因疗法铺平了道路。在这篇综述中,我们概述了治疗策略,并重点介绍了 PGD 治疗方法的一些最新进展。
非双重遗传病的基因组编辑......
《自然》杂志上发表的一篇文章( Anzalone 等人,2019 年)报道了一种基因组编辑实验方法的开发,该方法无需双链断裂 (DSB) 或供体 DNA (dDNA) 模板,即可介导人类基因组中所有可能的碱基到碱基的转换、“插入/缺失”和组合。Prime 编辑是一种新颖的基因组编辑方法,它利用一种比平常更长的单向导 RNA (gRNA),称为 Prime 编辑 gRNA (pegRNA),以及一种由 Cas9 H840A 切口酶与工程逆转录酶 (RT) 融合而成的融合蛋白。Prime 编辑被描述为“搜索和替换”碱基编辑技术,它在 gRNA 的延伸中提供所需的遗传构建体,然后使用 RT 酶将其转化为 DNA。与传统的 CRISPR-Cas 设备相比,新方法无需同时递送校正 DNA 模板,可执行所有可能的核苷酸替换(包括针对相当一部分遗传疾病的替换),解决插入/缺失引起的移码问题,并减少脱靶编辑。Prime 编辑是对现有 CRISPR 编辑系统的一个令人兴奋的新补充,在许多情况下甚至可能是一种改进。然而,Prime 编辑带来了新的挑战。克服这些障碍并在体内应用 Prime 编辑,将带来针对罕见遗传疾病的新型基因组编辑疗法。
印度罕见遗传病和药物研发研究现状
迄今为止,印度的主要卫生议程优先考虑传染病和公共卫生。鉴于社会经济条件和贫困,很大一部分印度人口受到不同病原体的感染,最明显的是肠道、寄生虫、分枝杆菌和病毒。然而,近年来,随着监测的改善、治疗的可用性、社会经济条件的改善和教育的提高,这些疾病的传播有所下降。现在人们意识到非传染性疾病在印度已达到流行的程度,人们更加重视这些疾病的诊断和管理。非传染性疾病造成的死亡比例大幅上升,2016 年约占所有死亡人数的 61.8% ( https://www.wbhealth.gov.in/NCD/ ) 这些疾病的四大类是心血管疾病、慢性呼吸道疾病、糖尿病和癌症,其中一些疾病具有共同的风险因素,包括与生活方式相关的行为。政府政策发生了转变,更加重视预防和管理非传染性疾病。卫生和家庭福利部 (MoHFW)(国家卫生使命 2023)已启动具有明确预算拨款的计划来控制这些疾病。虽然这些举措值得称赞,但它们往往只包括最常见的非传染性疾病。相对罕见的疾病(其中大多数具有遗传起源)在这些计划中没有找到一席之地。近年来,印度对罕见遗传病的认识逐渐提高,这些疾病也引起了科学家、临床医生和政策制定者的关注。很明显,这些疾病并不像人们普遍认为的那样罕见,印度人口因所有罕见疾病所承受的总体负担非常沉重。此外,95% 以上的罕见病都无法治愈。不幸的是,大多数现有疗法的价格远远超出了印度人的购买力,部分原因是这些疗法的开发和生产是在国外进行的,而新技术平台的知识产权(其中一些新疗法的基础)归国际制药公司所有。总体而言,大约 2900 个基因的突变导致大约 7300 种遗传病,其中大多数在本质上都是罕见的。然而,这项研究是在全国各地以分散的方式进行的。研究罕见遗传病可以提高我们对基因功能和生理之间关系的理解。这些天然遗传变异是一种强大的资源,为科学家通过基因型-表型相关性了解基础生物学提供了巨大的机会。在最近为了解这些疾病的研究水平而组织的一次会议(2023 年罕见遗传病研究峰会)中,很明显,印度有大量科学家和临床医生正在研究罕见遗传病。以单卷形式记录研究很重要,这可以有用地反映所取得的进展,了解差距领域,并规划该国未来的研究方向。本期特刊旨在展示印度一些主要的罕见病研究工作。它还应该有助于提高人们对这一广阔研究领域的认识,具有很高的翻译机会。
基因治疗选择作为遗传病的新治疗方法......
远端神经病变的发生率高于近端神经病变,因为神经直径较小,更容易发生退化。临床上,IPN 可细分为遗传性运动和感觉神经病或 Charcot-Marie-Tooth 病、远端遗传性运动神经病以及遗传性感觉和自主神经病 [2]。全球 IPN 患者总数估计超过 300 万。目前,IPN 的治疗选择非常有限。尽管在动物研究中验证了疗效后,已进行了几次减轻或改善疾病表型的尝试,但临床益处仍不确定。例如,维生素 C 在啮齿动物模型中被证明是成功的,然而,其疗效无法在临床试验中复制 [3-5]。最近,PXT3003(一种由巴氯芬、盐酸纳曲酮和 D-山梨糖醇组成的新型组合)正在进行临床评估,但临床益处需要进一步阐明 [6-8]。事实上,临床实践中不令人满意的结果可以归咎于不适当的治疗。
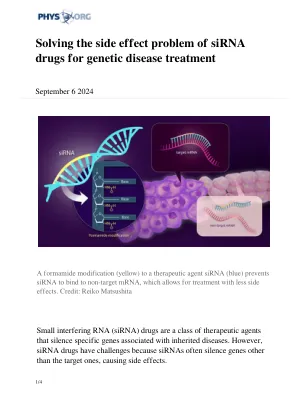
解决siRNA药物治疗遗传病的副作用问题
“脱靶效应很可能发生在存在与 siRNA 种子区域形成碱基配对的非靶标 mRNA 时,”Hiroshi Abe 教授解释道。“我们意识到,可以通过化学修饰降低该种子区域的碱基配对能力或双链稳定性来抑制脱靶效应,确保只有当整个引导链与靶标 mRNA 结合时才能形成稳定的复合物。”
纯合家族性遗传病治疗的进展...
纯合家族性高胆固醇血症 (HoFH) 是一种罕见的遗传性疾病,低密度脂蛋白胆固醇 (LDL-C) 极度升高,导致早在儿童时期就过早出现动脉粥样硬化性心血管疾病 (ASCVD)。HoFH 的治疗以积极充分降低 LDL-C 水平为中心,以减缓 ASCVD 的发展轨迹。从历史上看,降低 HoFH 中的 LDL-C 水平一直很困难,因为 LDL-C 水平显著升高(通常 > 400 mg/dL)并且对他汀类药物等治疗方法的反应降低,而他汀类药物的作用机制需要功能性 LDL 受体。然而,在过去十年中,HoFH 的治疗前景迅速发展。虽然他汀类药物和依折麦布仍然是一线治疗,但患者通常需要联合多种疗法才能达到目标 LDL-C 水平。 PCSK9 抑制剂是近期新增的重要治疗选择,此外还有洛美他派、胆汁酸螯合剂以及可能的贝培酸。此外,ANGPTL3 已成为重要的治疗靶点,evinacumab 是市场上首个可用于治疗 HoFH 患者的 ANGPTL3 抑制剂。对于无法充分降低 LDL-C 的患者,可能需要进行脂蛋白分离术,其额外好处是降低脂蛋白 (a) 水平,而如果 HoFH 患者的脂蛋白 (a) 水平也升高,则会带来额外风险。最后,使用 CRISPR/Cas-9 的基因治疗和基因组编辑正在进入临床开发阶段,可能会极大地改变 HoFH 未来的治疗格局。
在希望与现实之间:通过核酸药物治疗遗传病
与一般人群相比,罕见病 (RD) 影响的人数较少,且大多是遗传性疾病。最初的临床症状通常出现在出生或儿童时期,患者忍受着剧烈的疼痛和逐渐丧失自主能力,这通常与预期寿命短有关。直到最近,RD 的低患病率和诊断的延迟一直阻碍着研究。基于核酸 (NA) 的疗法时代彻底改变了 RD 治疗的格局,随着一些基于 NA 的疗法现在进入临床阶段,疾病改良药物开发的前景也带来了新的希望。在此,我们回顾了已获批准和目前正在研究用于治疗 RD 的基于 NA 的药物。我们还讨论了基于 NA 的疗法和递送系统的最新结构改进,这些改进克服了其市场扩展的主要限制,以及目前为解决内体逃逸问题而开发的方法。我们最后就这项新技术在监管批准和生产可持续性方面引发的道德和社会问题展开了讨论。
人工智能对优化罕见遗传病诊断和治疗方案的影响
1. 外科,贾比尔·艾哈迈德·贾比尔·萨巴赫医院,科威特城,科威特 2. 医学院,阿勒颇大学,阿勒颇,叙利亚 3. 穆塔大学医学和外科,卡拉克,约旦 4. 内科,梅奥医院,拉合尔,巴基斯坦 5. 内科,利亚卡特医科和健康科学大学,海得拉巴,巴基斯坦 6. 内科,圣约瑟夫区域中心,米什瓦卡,美国 7. 儿科,肯塔基大学医学院,列克星敦,美国 8. 内科,真纳信德医科大学,卡拉奇,巴基斯坦 9. 全科,马哈瓦伊基础医院/奥达基金会,卡利科特,国家临时居民区 10. 医学院,马尼帕尔医科大学,博卡拉,国家临时居民区 11. 创伤和骨科,皇家什鲁斯伯里医院,什鲁斯伯里和特尔福德医院 NHS 基金会,什鲁斯伯里,英国12. 加勒比医学院内科,圣乔治,GRD 13. 布鲁克林威科夫高地医院外科,美国
罕见遗传病:新治疗策略和人类生物学见解
过去十年,治疗遗传性疾病的创新理念急剧增加,而这些疾病目前尚无治愈方法。基因和蛋白质替代疗法是治疗这些疾病中的一组新方法,例如某些组织脆性病症。此外,干细胞方法的出现,例如诱导性多能干细胞 (iPSC) 技术,已导致开发出用于再生医学的替代组织的新方法。这与基因组编辑技术的发现不谋而合,该技术可以纠正致病突变。这些发现的最终结果表明,影响单个器官或组织的单基因疾病的新型创新疗法即将出现。然而,挑战仍然存在,尤其是对于在发育过程中同时影响多个组织和器官的疾病。这类疾病的例子包括外胚层发育不良,这是一种影响皮肤、角膜和上皮附属物等组织和器官发育的遗传性疾病。基因或蛋白质替代策略不太可能成功解决这些疾病的多器官表型。相反,我们认为更有效的方法是专注于纠正受累最严重的组织中的表型。这可能包括生成替代组织或识别纠正特定组织中疾病途径的药物化合物。