机构名称:
¥ 5.0
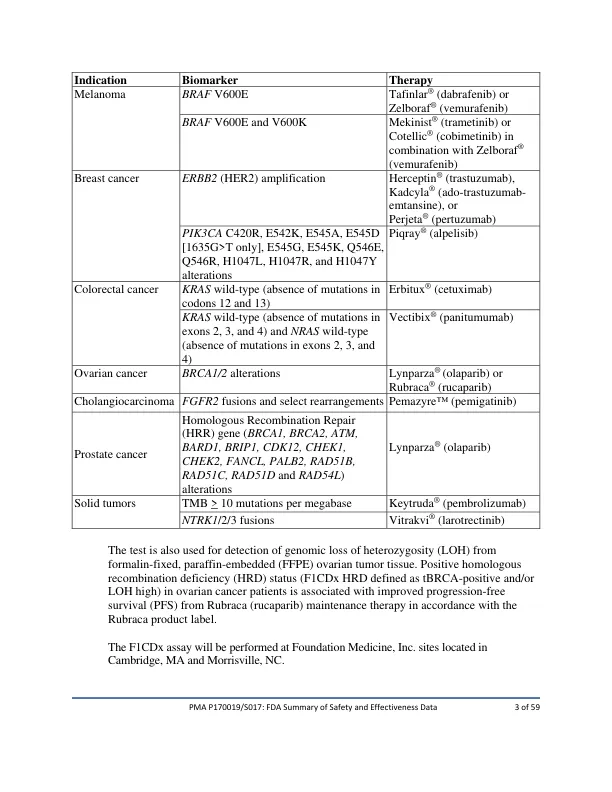
最初的PMA(P170019)用于基础CDX于2017年11月30日批准,用于检测可能受益于非小细胞肺癌(NSCLC),黑色素瘤,乳腺癌,结婚癌症(CRC)和Ovarian Cancer的15种FDA批准疗法之一。随后,批准了九种PMA补充剂以扩大F1CDX的适应症,因为它是其最初批准的。PMA补充(P170019/S005)用于添加杂合性基因组损失(LOH)的PMA补充剂(P170019/S004)在2019年7月1日批准了BRCA1/2改变的卵巢癌患者中添加Lynparza®(Olaparib)指示的指示。PMA补充(P170019/S008)在NSCLC患者中添加Tagrisso®(Osimertinib)的指示EGFR EXON 19缺失和EGFR EXON 21 L858R变化的指示,于2019年7月1日获得批准。PMA补充剂(P170019/S006)在2019年12月3日批准了PIKRAY®(Alpelisib)对PIK3CA改变的乳腺癌患者的指示(Alpelisib)的指示。PMA补充(P170019/S010)在北卡罗来纳州莫里斯维尔添加第二个网站,该网站将于2019年12月16日批准。PMA补充(P170019/S013),用于在2020年4月17日批准使用FGFR2融合的胆管癌患者中添加Pemzyre®(Pemigatinib)的指示(pemigatinib)。PMA补充(P170019/S011)在NSCLC患者中添加了MET单核苷酸变体(SNV)和导致MET 14跳过的NSCLC患者中添加TabRecta®(Capmatinib)的指示。
安全性和有效性数据摘要(SSED)