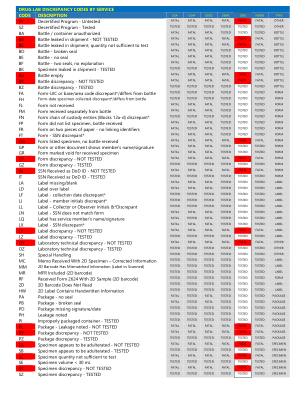
机构名称:
¥ 1.0
对于人类药物,CDER调节剂希望确保在药物进入任何人进行测试之前,已在实验室动物中进行了广泛的评估。过分简化的是,要求使用啮齿动物(大鼠或小鼠)和一种较大的哺乳动物物种(最常见的狗)进行毒理学评估。这些研究试图预测人类可能的毒性。这些药代动力学,代谢和毒理学研究的设计,成本和长度的细节因药物而异,但通常一旦为每个物种定义了药代动力学特征,该化合物的剂量将在至少3个月内以多剂量水平给药,通常更长的时间(9-12个月)。可能需要其他研究,例如致癌性和代谢研究。可以使用大鼠或小鼠作为药物作用的模型进行实验。实验动物中的这些研究称为临床前研究。也就是说,在人类进行测试之前。这些研究完成后,将分析数据并提交给FDA CDER进行审查。如果CDER审稿人确定数据足以表明该药物可以安全地在人类中进行测试,则他们会发出研究新药(IND)数量(IND),并且可以进行人类研究。
术语事项:了解动物与人类药物发育的差异
主要关键词