机构名称:
¥ 1.0
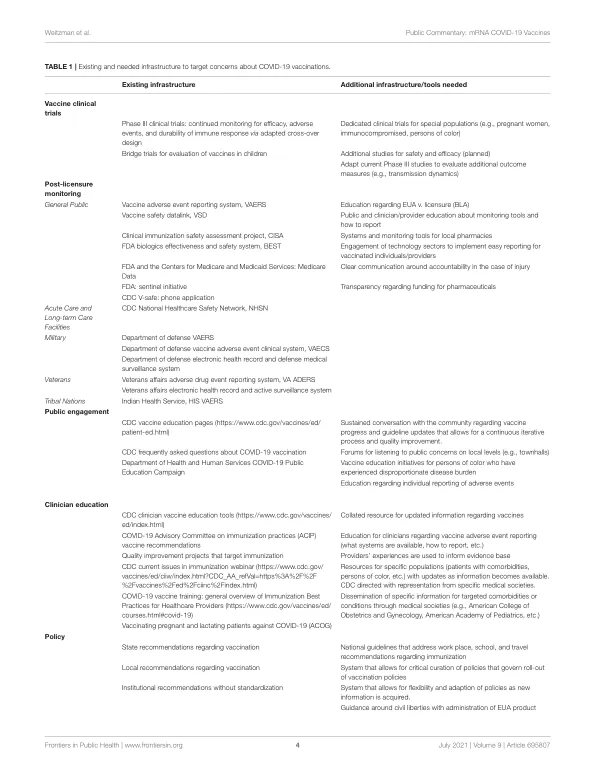
在美国食品药品管理局 (FDA) 疫苗和相关生物制品咨询委员会 (VRBPAC) 于 2020 年 12 月 10 日和 17 日举行会议后,辉瑞 BioNTech (BNT162b2) 和 Moderna (mRNA-1273) 疫苗获得了紧急使用授权 (EUA)。达到这些里程碑具有历史意义和鼓舞人心,但 COVID-19 疫苗的可接受性并非理所当然。知情且明确的临床指导、值得信赖的发言人、商业和科学的透明度以及对个人风险的认知推动了疫苗的可接受性 (1,2)。这些条件在新型疫苗获得 EUA 之后可能尤为重要,但 COVID-19 大流行的特点对它们不利。美国联邦机构、世界卫生组织和私营部门内部和之间存在着紧张关系。此外,疫情已经被政治化,通过社交媒体传播疫苗错误信息的情况猖獗 (3,4)。不同群体和国家之间病例数量的巨大差异,加上健康素养较差,加剧了人们的怀疑,降低了人们的信心 (5)。为了进一步了解对 mRNA COVID-19 疫苗 EUA 的担忧,我们审查了提交给 VRBPAC 会议的公众评论。我们试图了解接种疫苗以改善疫情的机会与 EUA 下疫苗推广的犹豫之间的脱节之处。从这些公开文件中出现的主题表明,需要建立一种公众、疫苗学家和公共卫生科学家、医疗保健提供者、制药利益相关者和政策制定者之间统一合作的模式。该模型将实现学习免疫
美国对 SARS-CoV-2 mRNA 疫苗的态度......
主要关键词